團結試驗
」 高端疫苗 高端 WHO
廖偉翔質疑高端疫苗採購 疾管署:絕無不法
國民黨立委候選人廖偉翔日前公布高端疫苗董事會及審計會流出的三份現場錄音檔,並有人轉述成大醫師說政府「穩過的,一路開綠燈」。針對廖偉翔持續對高端COVID-19疫苗採購案提出質疑。對此,疾管署今(2)日表示,有關檢方偵查相關案件共63案都以「查無不法」簽結,顯示政府無涉及任何不法情事。國民黨立委候選人廖偉翔近期猛攻高端COVID-19(2019冠狀病毒疾病)疫苗採購案,並提出3段疑為高端內部董事會及審計會的錄音檔,提及疫苗價格及「一路開綠燈」字句,音檔中甚至提到:「疫苗價格不能低於新台幣700元,其他都能當獎勵、全部拿到董事會。」衛生福利部疾病管制署副署長羅一鈞今天下午在例行疫報中再度嚴正澄清,強調依法採購及審查COVID-19疫苗,絕無外界質疑「一路開綠燈」情事。羅一鈞表示,疾管署在民國111年11月14日即以新聞稿公開說明,高端疫苗單劑量採購數量為200萬劑,每劑價格為新台幣881元;多劑量採購數量為280萬劑,每劑價格810元。均較BNT、莫德納的採購單價為低。此外,食藥署也在110年7月23日,以新聞稿公開說明國產疫苗審查無行政瑕疵,台灣對COVID-19疫苗緊急使用授權(EUA)審查基準及應具備的技術性資料要求,於109年10月14日即經專家會議討論後定案,並於廠商啟動第二期臨床試驗前,提供審查資料查檢表供其參照執行。疾管署強調,高端疫苗於110年10月27日獲選加入世界衛生組織(WHO)團結試驗,高端疫苗於真實世界接種的保護效益資料亦於112年12月28日被國際期刊Emerging Infectious Diseases接受,可佐證高端疫苗具有保護效益。疾管署重申,針對COVID-19疫苗採購與接種推動,均秉持專業且以全民健康福祉為優先,一切依法行政,絕無涉炒股或其他不法之事,有關檢方偵查相關案件共63案均以「查無不法」簽結,顯示政府無涉及任何不法情事。如有任何不法事證請提告,違法事項絕對依法徹查、嚴正法辦,絕不寬貸。
高端保護力報告未補件「恐被廢止EUA」 李秉穎爆:品質不好
高端疫苗去年取得國內緊急使用授權(EUA),食藥署要求一年內檢送保護效益評估,然而今年7月繳交相關報告後,還需要在10月底前補件,否則將廢止EUA。對此,衛福部傳染病接種諮詢委員會(ACIP)預防接種組召集人、台大兒科醫師李秉穎今天(20)日更爆料,高端有送報告,但是品質不好。資深媒體人周玉蔻在廣播節目《新聞放鞭炮》指出,她看到高端的聲明,但沒有看到真正的內容是什麼,如果問題出在WHO,那應該將過程、為何團結試驗這麼久還沒下來等公開說明,「因為你拿了國家的預算是30幾億快40億,這個是合理的嗎?」她強調,高端如果真的有障礙,應該要告訴大家,「如果你覺得需要的話,我願意配合你呀,不是每天躲在後面發聲明,像話嗎?我們對你期待這麼深」。李秉穎醫師爆料高端報告有送,但是聽說品質不好。(圖/翻攝自寶島聯播網YouTube)據了解,高端過去曾透露銷售通路有馬來西亞和巴拉圭,不過李秉穎表示,高端有在巴拉圭試驗,理論上應有銷售巴拉圭的計劃,「可是問題是沒有」,昨天的聲明內容提到,唯一的訂單是台灣,而申請緊急授權的國家僅有澳洲,讓他相當納悶,「其他國家都沒有」。李秉穎更爆料,因為高端報告有送,「但是品質不好,我沒有看到,聽說的」,不過他認為高端還是很好的疫苗,只是處理的方法可以再好一點,「有一些該做的事情,是不是沒有很積極的去做?」
周玉蔻批高端害她成「倒霉族」籲別把責任推給政府 高端火速發聲明回應
資深媒體人周玉蔻今(13日)在廣播節目《新聞放鞭炮》中,稱自己變成「倒霉一族」,因為高端不在日本目前認證的疫苗名單當中,造成她明明已經打了3劑高端,現在要去日本,還是得自3500元測PCR,讓她覺得非常不合理,大罵高端應該出面與日本政府溝通,不應該將責任推給指揮中心。對此,高端疫苗火速發表聲明回應,強調高端新冠疫苗依循台灣法規單位標準進行開,是台灣認可的正式EUA疫苗,公司已經在9月份陸續提供指揮中心相關文件和補充資料,協助政府部門與日本進行溝通,期盼能夠盡快提供民眾更便利的赴日方式。高端疫苗聲明全文:1.日本入境檢疫規定日本目前入境檢疫規定僅接受WHO緊急使用清單(EUL) 之新冠疫苗接種證明,尚不包含已取得台灣EUA的高端疫苗。高端新冠疫苗依循台灣法規單位之標準進行開發,為台灣認可之正式EUA疫苗;日本入境檢疫要求並非藥證申請審查,不屬於廠商主動向日本政府藥監單位提出申請之事項,因此,高端疫苗已於九月份提供疫情指揮中心相關文件,並陸續提供其他補充資料,協助政府部門進行溝通。高端疫苗將配合台日雙方政府之持續協商,盼盡快提供民眾更便利的赴日旅遊方式。2.國際認證進度高端新冠疫苗因良好的研發成果受到WHO肯定,進而入選團結試驗疫苗(STV),由WHO主導執行全球臨床三期,目前靜待其公佈臨床結果;此外,高端疫苗也自行於國外執行免疫橋接三期試驗。由於台灣並非WHO成員國,高端疫苗無法於取得台灣認證後直接申請WHO認證,需經第三國藥監單位的協助,才得以提出申請。目前高端疫苗已向澳洲藥監單位TGA及WHO相關主管部門正式提出申請緊急使用許可,如有任何進度更新,即依法規公告。台灣因政治處境特殊,台灣本土疫苗廠欲取得國際認證之難度遠高於其他國外疫苗公司。雖有此客觀限制條件,高端疫苗全體員工仍將全力以赴,為國際認證之目標努力。3.疫苗保護效益(effectiveness)報告高端新冠疫苗於2021年取得台灣緊急使用授權 (EUA) 時,衛福部食藥署要求於今年(2022)檢送疫苗保護效益(effectiveness)報告,本公司已如期繳交,並於專家會議上報告說明。日前收到食藥署審查補件要求後,已積極準備相關資料,將依要求及規範如期於10月底完成補件。

高端疫苗交貨延遲沒挨罰? 指揮中心這樣說
審計部近日提出調查報告指出,高端疫苗在交貨時有多次逾期紀錄,其中有不少次逾期超過30天,但衛福部卻僅針對每日逾期的部分計罰,應要求針對逾期30天的部分計罰,否則違反契約規定。中央流行疫情指揮中心今天表示,在審計部今年1月提出相關意見後,指揮中心即於3月24日依相關規定計罰。審計部報告指出,截至今年1月15日為止,疾管署共辦理12次高端疫苗驗收,其中有4次逾期超過30天,但疾管署卻僅針對每日逾期部分計罰,與契約規定不合。指揮官王必勝解釋,指揮中心是在3月高端完成最後一次交貨後,一併將先前違約的部分計罰,並沒有未依規定辦理,也不是因為審計部前來查帳才說要罰,而是內部有相關的作業程序。外界質疑,若依審計部透露的計罰部分價款2%違約金推算,每劑高端價格高達1028元,並非先前被爆料的881元,王必勝也否認,強調1028元這個是完全錯誤的推算,「我覺得差滿多的,因為這個推算基礎可能不對,不知道是怎麼算的。」王必勝強調,高端疫苗的實際價格,礙於商業的關係必須保密,至於先前與聯亞藥廠簽下的7.5億元合約,會在扣除經認可的必要費用後,依依請聯亞繳回,目前正進行作業。關於日本政府目前仍不承認高端疫苗,王必勝也再次澄清,強調「不是打高端就不能去日本」,只是日本現在規定入境要提出72小時內的PCR證明,但若有打三劑日方認可的疫苗,則可以不用做,因此打高端疫苗的國人,還是要去做PCR,並不是說不能去。王必勝也指出,目前都在持續與日方溝通,指揮中心已循相關單位,包含駐日代表處持續就高端議題與日本溝通,且也不是說日方拒絕承認高端,只是他們的規則是只承認WHO認可的。為爭取日方同意,是否會請高端直接向WHO申請EUL?王必勝透露,高端也曾經提出這樣的要求,不過目前就是要等團結試驗結果出爐,由於我國非WHO會員國,能取得的進度資訊相當少,因此還是要等WHO主動公布試驗結果才會知道。
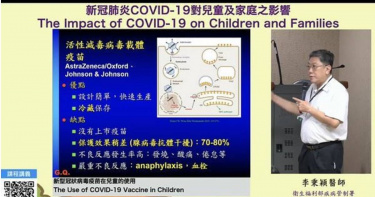
高端尚未得到世衛認證? 李秉穎怪給WHO:做事太慢
衛福部傳染病接種諮詢會預防接種組召集人、台大兒科醫師李秉穎今天(17日)在中華民國兒童健康聯盟研討會上抱怨,高端尚未通過世衛組織國際認證,並不是因為學術關係,而是WHO做事太慢。另外他也承認自己曾在2020年顧慮腺病毒效果不佳,而跟AZ公司表示,「這個疫苗進來我們不打」,但政府還是買了,反諷「這樣變成我在擋疫苗囉?」李秉穎17日上午以「新型冠狀病毒疫苗在兒童的使用」為題發表演講,除了分享腺病毒疫苗與mRNA疫苗的差別,也在Q&A時間回應高端為何尚未通過WHO認證的問題。李秉穎指出,mRNA設計簡單,可以在病毒發生突變時快速生產,還可以延長T細胞的保護力,使其達到95%的功效。「不過,mRNA疫苗也有缺點!」李秉穎稱,因為像BNT這類的mRNA疫苗會同時在肌肉、血液細胞、淋巴腺等器官內亂跑,所以會增加心肌炎及全身發炎的機率,但其保護效果還是比AZ好。李秉穎表示,「(AZ)接種第一劑有效,第二劑就被中和掉了。」因為AZ為活性腺病毒疫苗,遇到外來抗體的話效果會變差,這也是為何自己與AZ視訊時曾提到「這個疫苗進來我們不要打」的原因。李秉穎因此自嘲,自己當時形同在「擋疫苗」。另外,關於高端為何遲遲無法通過WHO的國際認證,他則表示「非學術因素」,雖然高端抗體跟Novavax一樣,也加入團結試驗,但原本預期3至4個月就可以結案,卻聽說WHO想看重症保護效果,所以又將計畫增加一倍,延至現在才做資料分析,「終究會有資料出來,但因為WHO做事太慢」。
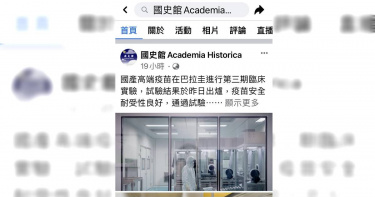
獨/國史館疑替高端疫苗做公關 蔡英文參觀照片也上臉書
高端疫苗股價去年「上沖下洗」遭各界質疑炒股,士林地檢署偵辦至今超過半年仍無重大進展,身為台灣最高史政機關、直接隸屬總統府的國史館疑似撈過界替高端疫苗做公關!昨天(2月15日)國史館在臉書PO出「國產高端疫苗在巴拉圭進行第三期臨床實驗」、「巴拉圭同步核准EUA」等訊息,最後還PO出總統蔡英文參訪高端疫苗照片,宛如一篇替高端疫苗和總統府聯合行銷的公關稿,引發司法界議論。國史館臉書PO文指出:國產高端疫苗在巴拉圭進行第三期臨床實驗,試驗結果於昨日出爐,疫苗安全耐受性良好,通過試驗設定優越性基準,與國內所執行之擴大二期試驗數據相當,巴拉圭同步核准EUA。此外,高端疫苗也已獲選為WHO團結試驗疫苗,以及取得國際組織「流行病預防創新聯盟(CEPI)」贊助,將執行更多試驗,期盼加速國際認證,並能協助全球防疫。文末還登出2018年總統蔡英文參訪高端疫苗公司照片。根據維基百科資料,國史館是中華民國政府的最高史政機關,為總統府直屬機構,以修纂國家歷史、史料整理、史料文物採集,以及行憲以來歷任已卸職之總統、副總統文物管理為主要任務。高端疫苗股價有如洗三溫暖,去年年初每股約91元,到5月間漲到高峰417元,去年還曾從高峰連吞6根跌停,接著又翻身4根漲停板,如此「妖股」般的表現,引發炒股、圖利質疑聲浪。最高檢察署去年6月間發交高檢署,要求瞭解高端股價異常狀況,高檢署發現高端公司負責人住在士檢轄區,指示士檢分案偵辦,士檢分「他」字案,指派專責檢察官進行調查。

高端獲WHO「正式冠名」 5檔疫苗概念股嗨翻
國產高端疫苗捷報不斷!近日受邀參與世界衛生組織(WHO)cepi covax流行病預防創新聯盟磋商會議,獲WHO「直接冠名」,市場解讀拿下國際認證「指日可待」。激勵高端疫苗(6547)8日漲停歡慶,大股東基亞(3176)、云辰(2390)「母以子貴」效應也發威,盤中齊衝漲停;原液生產台康生技(6589)同步勁揚逾7%。高端疫苗打氣不高,市場擔憂恐導致疫苗浪費問題,不過,其近日第七次受邀參與WHO cepi covax流行病預防創新聯盟磋商會議,而本次高端被賦予全新名稱,不再是僅以疫苗廠身分出席,而是獲WHO正式冠名,為「WHO Covid-19 vaccine research(medigen)」。國產疫苗曙光乍現、概念股同歡,利多消息一出,不僅激勵高端疫苗股價8日直衝漲停價279元,追平9月下旬的前高價位。連帶集團股基亞「母以子貴」效應也發威,股價以54元開出,盤中同樣一度亮燈漲停;云辰同樣也以22.7元開出,11點初也一度觸及漲停價24.55元。此外,從事原液生產的台康生技,股價8月也上漲逾7%,拉出長紅K棒一舉突破5日線、季線,改寫逾兩個月來新高價位;台灣最大的針劑廠台耀,過去也曾獲點名有望高端疫苗充填任務,股價小漲近3%,持續向上挑戰季線反壓。高端疫苗近期可謂捷報頻傳,不僅10月底獲選WHO「團結試驗疫苗」、11月又通過澳洲藥物管理局批准,得以「速件」申請新冠疫苗緊急授權,近期又再獲流行病預防創新聯盟(CEPI)約新台幣6,381萬元補助,以進行第三劑混打試驗。
高端今公布WHO團結試驗3期進度 完成3國、4000受試者收納
高端疫苗首次出現突破性感染案例,未有明確保護力數字是國人的疑慮;高端今公布,日前獲選為世界衛生組織(WHO)團結試驗疫苗三期試驗最新進度,WHO在哥倫比亞、馬利、以及菲律賓3個國家展開團結試驗疫苗收案,截至目前為止,超過40個試驗中心已完成4000位受試者收納。WHO團結試驗疫苗是一項多國多中心、多疫苗、適應性、共享安慰劑、隨機對照的第三期數萬人規模臨床試驗。高端疫苗是目前兩款入選的疫苗之一。高端疫苗表示,團結試驗疫苗選擇在跨越3大洲、3國進行萬人以上的傳統三期試驗,目的是獲得安全性,以及針對新冠病毒變異株的「保護力」相關數據。由於現階段疫苗仍為全球短缺的關鍵防疫物資,高端認為,團結試驗有助於加速試驗進行,評估具有潛力的候選疫苗,並開發有效疫苗,供世界各地的人們施打。
高端入選WHO團結試驗疫苗 第三期臨床試驗將展開
世界衛生組織(WHO)今公告,關於團結試驗疫苗聲明(WHO Statement on Solidarity Trial Vaccines),由WHO與哥倫比亞、馬利(非洲國家)、以及菲律賓衛生部,共同對外宣布全球團結疫苗試驗啟動;高端晚間重訊公告,高端入選WHO團結試驗疫苗,將展開全球第三期臨床試驗。依據WHO公告內容,團結疫苗臨床試驗於哥倫比亞、馬利及菲律賓3個國家,超過40個臨床試驗中心執行;經由獨立的疫苗優先次序諮詢小組 (the independent vaccine prioritization advisory group) 評選,目前已有兩項疫苗獲選。除高端的次單位重組蛋白疫苗,還有Inovio公司的DNA疫苗。WHO所主導的「團結試驗疫苗」是跨國的臨床試驗平台,目的在快速評估新候選疫苗的疫苗有效性(efficacy)和安全性,這些候選疫苗是由全球科學家和專家組成的獨立疫苗優先次序諮詢小組所挑選,除了高端新冠肺炎疫苗;Inovio的DNA疫苗以外,預計還會有兩項候選疫苗在完成科學審查後,加入此項團結試驗。WHO表示,團結試驗疫苗將加速具潛力新冠疫苗研發,讓疫苗組合更廣泛,目標是開發第二代疫苗,提供病毒變異保護及更長的保護持續時間。