東生華
」 乾眼症 東生華
獎勵計畫奏效!流感疫苗4天16.5萬人搶打 比去年同期增加26%
疾管署今(19)日表示,本流感季自今(113)年10月1日起截至11月18日累積219例流感併發重症病例(206例A型H1N1、9例A型H3N2、2例A型未分型、2例B型),其中34例死亡(33例A型H1N1、1例A型H3N2),流感併發重症確定病例數及死亡數均為十年同期最高,且34例死亡個案均未接種本季流感疫苗。疾管署說明,本流感季自今年10月1日起累積流感併發重症確定病例及死亡數均創十年同期最高,且以65歲以上長者發生比例最高,為使長者及幼兒於流感流行期來臨前獲充足保護力,該署自11月15日起實施「113年度提升65歲以上長者與6歲以下幼兒流感疫苗接種率合約院所獎勵計畫」,自113年11月15日起至113年12月31日止,每接種1劑次長者或幼兒,再額外給予50元獎勵,且若該縣市在長者幼兒接種率達標後,會再提高獎金。獎勵計畫推動後,長者及幼兒之接種量,已觀察到回升情形,至11月18日累計4天已接種約16.5萬人次,相較去年同期增加26%,顯示該措施實施發揮效用,有助刺激打氣。另,今年10月1日新冠疫苗開打以來,新增新冠併發重症個案均未接種新冠疫苗,目前受到東北季風影響,氣溫已明顯下降,預估新冠疫情可能在冬季升溫,呼籲65歲以上長者及慢性病患等高風險族群,趕快接種新冠疫苗及早獲得保護力。另除提升自我免疫保護力,為保護家人朋友,鼓勵民眾踴躍接種,以降低感染後併發重症及死亡風險。疾管署統計,截至11月18日止,公費流感疫苗接種數約505萬人次(疫苗使用率約78.5%),剩餘138.6萬劑;新冠疫苗則持續高於去年,已累計接種127.8萬人次,為去年同期(49.8萬)2.6倍,隨著入秋最強冷空氣來襲,呼吸道病毒將更活躍,呼籲長者及幼兒仍應儘速完成疫苗接種,以獲保護力,降低感染後發生重症和死亡風險。民眾可先透過各地方政府衛生局網頁、疾管署流感防治一網通(https://antiflu.cdc.gov.tw/)、疾管家或1922防疫諮詢專線,查詢鄰近合約院所,再電洽院所詢問預約,以確保可施打到疫苗且節省排隊等候時間。
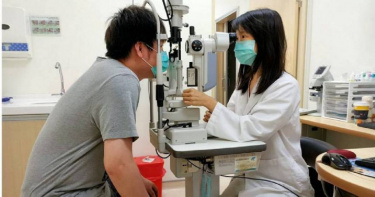
乾眼症患者10年增7成 「全球首款鼻噴液藥」將在台上市
全世界首款以鼻噴給藥方式治療乾眼症的星特潤®TYRVAYA®乾眼症噴鼻液,已獲得衛福部食藥署的新藥取證通知,這是東生華(TW-8432)今年內成功取得的第二個藥品上市核可。東生華總經理楊思源表示,星特潤®TYRVAYA®於2021年通過美國食品藥物管理局(FDA)新藥許可證並成功上市,這款由美國製藥公司Oyster Point Pharma研發的新藥,將為台灣乾眼症患者帶來突破性的治療選擇。去年,東生華通過與箕星藥業的策略合作,迅速展開星特潤®TYRVAYA®在台灣的查驗登記與商業化運作,歷經不到一年即取得藥證。乾眼症是一種複雜且多因素導致的眼表疾病,表現為淚膜受損,嚴重影響患者的生活品質。東生華所推出的星特潤®TYRVAYA®,屬於一種高選擇性的膽鹼受體促效劑,可促進天然淚液的分泌。在臨床試驗中,參與的1403名乾眼症患者在使用星特潤®TYRVAYA®兩週後,症狀和癥兆即有所改善,持續使用四週後,天然淚液分泌量仍顯著增加。楊思源總經理引用《財富商業洞察》(Fortune Business Insights)的數據指出,全球乾眼症治療市場預計在2030年將達到113億美元,預測年複合成長率為7%。而根據台灣衛福部的資料統計,全台乾眼症門診就醫人數在近10年間激增七成,顯示市場需求日益攀升。
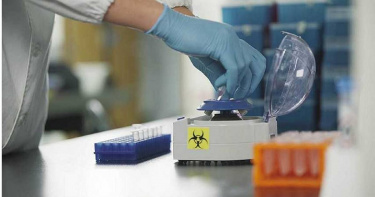
東生華再創台灣首例 體液NGS基因檢測通過LDTs核准
東生華 (TW-8432) 在次世代基因檢測(NGS)領域再次創下里程碑。今年8月台灣首篇液態切片(胸水)研究成果成功發表於國際期刊,在10月也成功獲得台灣衛福部核准,成為首例通過「實驗室開發檢測與服務」(Laboratory Developed Tests and Services, LDTs)的液態切片(體液)NGS 基因檢測。隨著台灣於今年2月落實LDTs認證,東生華於本月正式通過該項認證。衛福部於10月8日發函核准確認通過三項檢測項目,包括「癌克準-100 組織切片」、「癌液準-100 液態切片(體液)」及「癌液準-100 液態切片(血液)」。其中,癌液準-100液態切片(體液)是專門獨立針對癌症患者胸水、腹水及腦脊髓液進行NGS基因檢測產品,為台灣首例通過LDTs審查許可。癌液準-100 液態切片(體液)突破了傳統細胞塊檢測的局限。相較於傳統方法只能檢測到約51%的癌症驅動基因突變,東生華的液態切片技術識別出超過92%的突變,涵蓋常見的 EGFR、ALK、ROS1 等基因,以及罕見的非熱點區域突變,如 EGFR、KRAS、MET exon14跳躍突變、NRAS、BRAF和ERBB2擴增等。癌液準-100 液態切片(體液)在靈敏度和檢測範圍上顯著優於傳統檢測。此外,液態切片相對於組織活檢具備更低的侵入性,且能在平均7天內提供報告,大幅縮短了檢測時間,提供了快速且精準的臨床決策依據。目前,該技術已在台灣多家醫學中心完成臨床驗證,累計檢測超過1000例。東生華的液態切片產品不僅為癌症基因檢測帶來了新突破,也在精準醫療領域邁出了重要的一步,讓台灣在國際上更具競爭力。

藥廠、陽明交大產學合作 篩選靶點AI精準藥物開發
東生華(TW-8432)與國立陽明交通大學醫學院(簡稱陽明交大)今(22)日簽署為期五年的產學合作備忘錄(MOU)。此次合作聚焦「人才培育」及「精準藥物開發」兩大重點,透過早期驗證特定靶點新功能及AI篩選藥物,以提高新藥開發成功率,縮短上市時程並降低成本。東生華董事長林全強調:「生醫產業特色是研發耗時長,但產品生命週期也長,因此優秀人才培育是推動產業創新的關鍵之一。我們希望藉由陽明交大豐沛的研究底蘊搭配AI精準藥物開發,加上東生華的商品能力,共同為高齡化社會人民健康福祉盡一份心力,為台灣醫療產學合作樹立新典範。」東生華在心血管疾病、腸胃科、眼科及中樞神經用藥等領域皆擁有新藥,陽明交大則結合生物醫學及電子通訊兩大領域優勢,在生物技術與藥物研發方面擁有多項專利,並在心血管、糖尿病、腎臟等慢性疾病領域有深入研究。此次MOU整合雙方優勢,將強化生物技術與藥物研發合作,尤其聚焦於血管病變、器官保護及抗老化等領域。通過早期驗證特定靶點新功能、專利申請及AI篩選藥物,雙方致力於滿足臨床上尚未被滿足的需求,同時提高新藥開發效率。陽明交大校長林奇宏表示:「此次合作有助於學生探索生技製藥產業、醫療環境與人文社會經濟發展,透過跨域學習與實踐,思索未來職涯方向,培養下一代兼具科學與人文素養之優秀人才。」
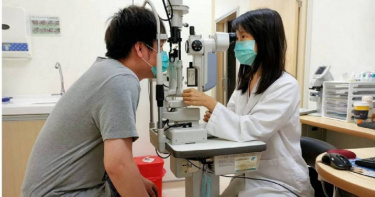
全球首款乾眼症鼻噴劑 年底可望在台取證
台灣目前約有300萬的民眾受乾眼症所苦,乾眼症是一種由多種因素導致的眼表疾病,以淚膜受損為特徵。健康的淚膜能保護和潤滑眼睛、沖走異物,然而台灣現行的治療藥物卻尚未能滿足病患需求。東生華(TW-8432)引進全球第一個乾眼症治療鼻腔噴霧劑,其中的活性成分Varenicline,通過結合菸鹼型乙醯膽鹼(nACh)受體而發揮作用。當受體活化後,三叉神經副交感神經通路被激活,導致天然淚液分泌增加,從而達到治療乾眼症的目的。透過新的給藥途徑,藉此增加天然淚液分泌,適用於輕度至重度的乾眼症患者,提供更簡便、安全的用藥選擇。此款鼻腔噴霧劑已獲美國FDA批准作為多劑量包裝,治療乾眼症徵候及症狀, 東生華去年7月宣布在台的查驗登記和商業化權利,已於今年初接獲食藥署新藥查驗登記的續審通知,若審查順利有望於年底取證。東生華總經理楊思源表示,此款噴鼻劑是由美國製藥公司 Oyster Point Pharma 開發的新藥,並於2021年在美國獲得FDA新藥許可證並成功上市。東生華透過與箕星藥業合作,並進行台灣的查驗登記及商業化。根據兩項臨床試驗共940名乾眼症患者使用資料顯示,患者平均在僅使用一劑噴鼻液就有淚液分泌增加的改善,在使用2週期間,患者的乾眼症症狀和癥兆有明顯治療反應,使用4週後平均產生的天然淚液量仍然顯著增加,大幅改善患者生活品質。楊思源指出,乾眼症全球醫藥市場規模龐大,且呈現迅速增長。根據Global Data的「Dry Eye Syndrome: Global Drug Forecast and Market Analysis to 2028報告」,顯示自2018年到2028年,乾眼症的年複合成長率高達10.6%,預估至2028年全球市值最高可達111億美元。
全球首見!鼻腔噴劑激活副交感神經分泌淚液 乾眼症治療新選擇
東生華製藥總經理楊思源今(11)日宣布,將開拓新治療科別進軍眼科治療領域。根據調查發現,目前台灣約有300萬的民眾受乾眼症所苦,看準目標市場,東生華在眼科的首發產品是由美國Oyster Point Pharma所開發用於治療乾眼症的新藥。乾眼症是一種以淚膜受損為特徵的眼睛表面多因素疾病,須持續治療與保養。而人類天然淚膜則能保護和滋潤眼睛,洗去異物,含有生長因子和抗菌成分,形成光滑的表面,形成眼睛的主要屈光面。現行治療選擇卻無法完全滿足患者需求,因此東生華引進全球第一個乾眼症治療鼻腔噴霧劑,其中的活性成分Varenicline,通過結合菸鹼型乙醯膽鹼(nACh)受體而發揮作用。當受體活化後,三叉神經副交感神經通路被激活,導致天然淚液分泌增加,從而達到治療乾眼症的目的。透過新的給藥途徑,藉此增加天然淚液分泌,適用於輕度至重度的乾眼症患者,提供更簡便、安全的用藥選擇。根據2項臨床試驗共940名乾眼症患者使用資料顯示,患者平均在僅使用一劑後就有淚液分泌的增加,在使用2週期間,患者的乾眼症症狀和癥兆有明顯改善,使用4週後平均產生的天然淚液量仍然顯著增加。透過乾眼症治療鼻腔噴霧劑來增加天然淚液分泌,為乾眼症患者帶來更好的治療反應與感受,目前已在2021年取得美國FDA新藥許可證並上市,東生華與箕星今年正式簽約並啟動在台灣的查驗登記及後續的銷售準備。