EMA
」 疫苗 AZ疫苗 歐盟 接種 新冠疫苗
罕病AADC基因治療「價格近億」納健保採採分期支付 首年估13人受惠
AADC缺乏症是一種遺傳性罕見疾病,通常在嬰兒早期出現症狀。由台大醫院團隊研發的AADC基因治療,2022年獲歐盟上市許可,價格近億元。健保署藥物共擬會今天(21)審查通過健保給付,將和廠商啟動價量協議,預計最慢今年11月開始給付,預估第一年13名患者受惠。芳香族L-胺基酸脫羧基酶缺乏症 (AADC)是先天基因缺損,通常在嬰兒早期出現症狀,導致嚴重的發展遲緩、動眼危象、低張力及四肢運動異常、自律神經系統失調、睡眠問題及情緒障礙等。AADC基因治療是2010年由台大醫院基因醫學部提出「AADC治療計畫」,並陸續獲得AADC缺乏症病友會、罕見疾病基金會、長榮集團張榮發總裁及生技醫藥國家型科技計畫(NRPB)的支持贊助,之後技轉給美國藥廠。歐洲藥品管理局(EMA)於2022年核准這項基因治療藥物上市。健保署副署長龐一鳴證實,今天共擬會通過AADC基因治療納入健保給付,並授權健保署和廠商進行「價量協議」,牌價近億元,實際價格會低一些。共擬會專家認為,由於藥物價格高,採「分期支付」,觀察病人穩定有效才會給付。依據國健署統計至今年7月, AADC罕病通報72人、死亡27人、存活45人。而台灣新生兒發生率約三萬分之一,高於其他國家,如日本約16萬2千分之一、美國約6萬4至9萬分之一、歐盟約11萬6千分之一。龐一鳴表示,此次通過給付的重點不在於價格多貴,這類罕病病童若沒有幫忙就活不久,國家應該盡量照顧,且相對其他國家,台灣病人數較多,早期研發跟技術都是以台灣為基地,再向國際推廣,健保更應該要支持。龐一鳴說明,依照標準流程為2個月,最慢今年11月開始給付,預估給付後第一年使用人數13人。他轉述健保署長石崇良的話,「全台灣每一個人也只付不到5元,可以救一個罕病小朋友,絕對值得!」

新冠連5周升溫!疫苗打氣增2成 單日2810人創新高紀錄
新冠疫情連5周升溫!疾管署預估高峰期將會落在5~6月之間,隨著愈來愈多民眾確診,新冠疫苗打氣也直線往上衝,根據疾管署最新統計,本周近四日(5/12-5/15)新冠疫苗接種人數共計9,092人,較上周同期(5/5-5/8)接種7,512人增加21%,昨(15)日接種2810人更創約7周來單日新高,顯示民眾接種意願提升。疾管署表示,公費新冠疫苗庫存仍有約318萬劑,供應無虞,請年齡滿6個月以上民眾踴躍接種,在疫情高峰前提升自我免疫防護,以接種疫苗降低新冠中重症發生風險。疾管署說明,世界衛生組織(WHO)昨日公布最新新冠疫苗選株會議結論,認為目前的新冠JN.1疫苗仍具足夠保護力。由於全球流行主流仍為JN.1衍生的變異株,世衛專家小組於5/6-5/7開會評估目前使用的新冠疫苗株(JN.1或KP.2),結論為目前疫苗株仍有保護效果、為可持續建議選用的合適疫苗株,也同時建議新變異株LP.8.1為合適的替代疫苗株選項。由於五月中下旬美國食品藥物管理局(FDA)、歐洲醫藥管理局(EMA)也將陸續開會決定新冠疫苗選株建議,疾管署將視上述結論是否一致,必要時提ACIP討論我國秋冬新冠疫苗選株建議。疾管署提醒,雖然新冠病毒感染多為輕症或無症狀,但病程仍有機會發展為中重症。由於國內疫情持續上升,滿6個月以上且尚未接種新冠 JN.1疫苗者別輕視疾病威脅,應儘速接種。此外,已接種1劑且間隔6個月(180天)的65歲以上長者等3類高風險對象,應再接種第2劑,以提升免疫保護力。針對民眾抱怨買不到新冠快篩,食藥署副署長王德原表示,有關家用新冠快篩試劑國內已核准4張許可證,相關業者分別為寶齡富錦生技股份有限公司、台塑生醫科技股份有限公司以及亞培快速診斷設備股份有限公司,另專業人士用新冠快篩試劑已核准6張許可證,目前整體供應量能充足。王德原說,已主動聯繫四大超商、連鎖藥局等通路,針對家用新冠快篩試劑請其協助鋪貨/備貨,以維持國內防疫量能,相關通路也表示會盡力配合政府政策,但目前仍須視各門市市場需求,不一定全省通路皆會鋪貨,建議民眾可至較大型的連鎖藥局購買。

25歲女星驚傳過敏性休克驟逝 經紀公司證實!2天前才發文:對不起
日本女星Hijiri Ema(ひじりえま)驚傳驟逝,她所屬事務所Medive production在8日發聲證實其死訊,坦言Hijiri Ema在7日因為過敏性休克離開人世,得年25歲。而Hijiri Ema生前最後貼文就在驟逝2天前,因為臨時無法出席活動和粉絲道歉,卻也成了她的遺言。綜合日媒報導,新生代女歌手Hijiri Ema所屬事務所Medive production於8日在X(前身推特)發表聲明,「對於突然宣布這個消息,我們深感抱歉,在2025年4月7日星期一,敝社藝人Hijiri Ema因過敏性休克驟逝。生前Hijiri Ema蒙受各方厚愛,在此表達誠摯的謝意。」日本女星Hijiri Ema(ひじりえま)離世,得年25歲,事務所發生證實噩耗。(圖/翻攝自X/ひじりえま)除此之外,事務所也表示,Hijiri Ema的後事依照死者與其家人意願,僅進行火葬,婉拒弔問、祭奠和供花,「盼外界給予家屬與事務所藝人充分的空間與理解,祝故人安息」。另外,據《朝日電視台》報導,Hijiri Ema驟逝後未公開她發病的具體情形,但病情迅速惡化,家屬相當難過。女歌手Hijiri Ema在社群上最後一則貼文,是在她猝逝前2天公開向粉絲道歉缺席表演,如今她永遠都不會出席了。(圖/翻攝自X/ひじりえま)而Hijiri Ema生前積極經營社群,她最後一則貼文就是5日在X上轉發一場活動的公告,她因為身體不適,無法出席於川崎CLUB CITT'A'TTIC舉辦的演出,最後只有她的夥伴三咲はる獨自登台,主辦單位向粉絲道歉外,她本人也在轉發公告的貼文致歉,和大家說「對不起」。不料,Hijiri Ema這篇貼文成了她最後公開的遺言。Hijiri Ema在1999年8月14日出生於神奈川縣,以歌手身分出道,還是雙人音樂企劃《Ravi Lavie》與多成員團體《狂想ノ六重奏》成員之一,受邀不少表演活動和主持,長得甜美外也多才多藝,更有自己作詞作曲,展現創作音樂人的面貌。

「菸」關難解1/加熱菸審查進度延宕兩年 國健署審查機制究竟哪裡卡關?
行政院日前公布院版的立法院下會期優先法案修法,其中包括兩年前修正菸品「一禁一管」政策的《菸害防制法》,然而被納入管制的加熱菸至今卻一直卡在衛福部無法上市,外界多認為係衛福部刻意營造模糊遊戲規則「技術卡關」所致,如今《菸害防制法》再度提出審議,料將引發各方角力。《菸害防制法》於112年3月22日修正上路,對於新型煙品採「一禁一管」方式,法條「一禁」所謂係指全面禁止電子煙之類菸品,「一管」則將加熱菸納入管制,且業者所提資料必須通過「健康風險評估審查機制」才可製造、輸入,而至今近2年時間過去,卻未見一家加熱菸商通過評估。《菸害防制法》修正版於112年3月22日起實施,除全面禁止電子菸外,加熱菸必須通過健康風險評估審查才可上市販售。(圖/報系資料照)衛福部於《菸害防制法》修正版實施同日公告「健康風險評估審查辦法」,規定申請業者應檢附相關資料,並經由國健署邀專家學者開會評估審查才可上市;另訂申請案件處理時間以六個月為最長期限,必要時得予延長六個月,以延長一次為限,而業者補交資料時間不算在其中。根據部份菸商私下抱怨,他們早將相關資料送請福部國健署審查,然而國健署的審查機制卻沒有一套明晰的遊戲規則,導致審查效率奇差,對於加熱菸的上市時間實在不敢樂觀;國健署對外宣稱,因廠商沒有補充要求的資料,因此無法完成審查。民進黨立委陳瑩質疑,若推稱廠商沒有補充資料,國健署迄今開了37場審查會議的開會內容為何?審 查會議內容看似公開透明,遲遲不解決技術性卡關亂象,根本是瀆職。事實上,加熱菸審查辦法確有問題存在,一名知情人士指出,以新藥查驗及指定菸品審查作比較,指定菸品審查補件次數及期限並不明確,導致加熱菸審查完全沒有截止日期。以新藥查驗為例,審查過程中有1次技術補件機會,期限為2個月,得展延1個月;指定菸品補件次數及期間卻沒有明確規範,申請者只得持續補件。《菸害防制法》修法施行滿周年,新北市衛生局已裁處輸入電子煙或加熱菸118件,累計監督銷毀近7000條加熱菸及加熱菸主機、類菸品等違規貨品,國健署遭批延宕加熱菸審議進度,導致稅捐稅收大量流失。(圖/報系資料照)該知情人士續指,指定菸品審查機制也並不精簡,以新藥查驗為例,若得到美國食品藥物管理局(FDA)、歐洲藥品管理局(EMA)或日本厚生勞動省(MHLW)其中兩地區的核准證明,並經評估不具族群差異者,審查時間得從240天縮減至180天,相對指定菸品審查卻未有此機制,對所有菸品採同一程序,不免有浪費行政資源之嫌。至今沒有加熱菸合法上市,也多次遭指造成稅收流失問題。新北市衛生局上月宣布查獲並銷毀6萬多條非法走私入境的加熱菸及電子菸,遭到CLEAN AIR大聯盟發起人彭華幹痛批,政府本可徵收到3108萬元的菸捐和菸稅,卻這樣一把火燒了。依現行有關菸品健康捐及菸稅規定,每包菸的菸捐加上菸稅為51.8元,據推估,加熱菸拖延上市一年的菸捐與菸稅加起來,大約260億到280億元。台酒董事長湯期安日前備詢時坦言,菸防法上路後,很多民眾轉用加熱菸,台灣菸酒遲遲無法銷售加熱菸,已影響到40、50億元的銷量。據了解,國內一年約銷售19億包香菸,如一包紙菸以120元計算,香菸市場一年銷售額約2280億;加熱菸因還未開放,無法推估一年銷售額,依衛福部目前推估,我國人口預估0.5%抽加熱菸。對此,綠營立委表示,加熱菸的市場需求既成事實,拖延上市只會造成走私品流行以及稅收流失,既然加熱菸已合法納管,就應正視政策矛盾,加速加熱菸審查進程,讓其儘快上市,政府才能有效管理產品,確保稅收與消費者安全。◎提醒您:吸菸有害健康、吸菸害人害己。

「臥底」東京小學150天 英日混血導演揭日本社會秘密
紀錄電影《日本人的養成》是日本女導演山崎艾瑪(Ema Ryan Yamazaki)的最新作品,導演鎖定了日本最大公立小學、擁有上千名學生的東京塚戶小學拍攝,並以一整個學年捕捉該校一年級和六年級學生的童年魔力,觀察他們是如何學習、並開始具備成為日本社會一份子應有的特質。該片獲美媒讚賞「令人大開眼界」,就連以教育聞名的芬蘭媒體,都給予「溫暖無比」的全面好評。紀錄片《日本人的養成》拍攝期間歷經疫情,導演山崎艾瑪還是堅持拍攝。(圖/海鵬提供)從小在大阪長大的導演山崎艾瑪,本身是英日混血,她對日本社會的獨特性十分感興趣,認為日本之所以能成為現在讓全世界稱羨的社會,最關鍵的答案就是因為日本的小學制度。為拍攝《日本人的養成》,山崎艾瑪在學校「臥底」150天,隨時掌握可能發生的事件,總計拍攝了700個小時。期間即使遭逢新冠疫情,她依然不願放棄,認為那是捕捉日本文化特質與教育真實面的絕佳機會,甘冒風險繼續拍攝,果然順利成功,獲美國日本當代電影節(Japan Cuts)盛讚「耳目一新!令人大開眼界」。英日混血導演山崎艾瑪對日本社會的獨特性十分感興趣,進而拍攝《日本人的養成》,貼身記錄小學生的生活及性格養成。(圖/海鵬提供)「日本人總是準時」、「日本人很有禮貌」、「日本人工作努力」,當電影《日本人的養成》在世界各國放映,果然引發驚嘆連連。日本要求學生自己打掃教室的學校體系,每個學生從小都被賦予責任和角色,「群體意識」成為日本獨有的特質。電影《日本人的養成》讓人們重新思考教育的功能並激發對話,更成為任何城市或國家當前教育體系的一面鏡子,連韓國媒體都誇讚該片「充滿樂觀希望」。電影將於10月25日在台上映。

瘦瘦針增自殺傾向?歐盟本周審查 美國FDA初步認定無關連
在特斯拉執行長馬斯克等名人的帶動下,俗稱「瘦瘦針」、「減肥針」的GLP-1藥物(Glucagon-likepeptide-1 agonists類升糖素胜肽-1受體促效劑)成為炙手可熱的減肥聖物,但從去年起便傳出可能會增加輕生傾向,歐洲藥品管理局 (EMA) 將於本週召開一次會議,審查有關 GLP-1 類減肥藥物與自殺傾向是否有關聯的報告。中國附醫健康醫學中心副院長、台灣肥胖醫學會理事長林文元表示,GLP-1藥物本來是一種降血糖藥,在研發過程中,發現血糖下降的同時,體重也在下降,所以在國外很早就用於減重。瘦瘦針藥物種類相當多,目前台灣大致有Liraglutide、Dulaglutide、Semaglutide等3大類,隨著民眾搶買減肥針,全球都出現短缺狀況。歐洲藥品管理局去年接獲冰島通報,1例使用抑制食慾的胰妥讚(Semaglutide類藥物)後導致出現自殺念頭、1例使用善纖達(Liraglutide類藥物)想自殺、另1例使用善纖達出現自殘想法。Liraglutide、Semaglutide類藥物均由諾和諾德(Novo Nordisk)製造。目前歐盟藥物產品訊息中並未將自殺行為列為副作用,相關產品的安全性將由「藥品監測暨風險評估委員會」(Pharmacovigilance Risk Assessment Committee, PRAC)進行評估,日後將考慮是否將審查範圍擴大到「類升糖素胜肽-1受體促效劑」(GLP-1 receptor agonists)的其他藥物。諾和諾德對此回應,GLP-1受體促效劑應用於治療第2型糖尿病已有超過15年的歷史,用於治療肥胖症也有8年的歷史。從大型臨床試驗項目和上市後監測收集的數據中,並無證據顯示其藥物與自殺自殘傾向存有關聯。諾和諾德強調會持續監測正在進行的臨床試驗和實際使用其產品的數據,並與當局密切合作,以確保患者安全和向醫療保健專業人員提供足夠的信息。美國食品藥物管理局 (FDA) 今年1月的初步審查發現不存在自殺關聯,不過,FDA同時警告,鑑於數據有限,不能完全排除有這種風險的可能性,之後將繼續關注這一問題。

深挖減肥神藥潛力? 彭博:藥商正佈局6歲以上兒童肥胖領域
據彭博報導,有知情人士透露,禮來公司(Eli Lilly)正在計劃在6歲以上年齡段的肥胖症患者中測試其糖尿病藥物Mounjaro;諾和諾德(Novo Nordisk)也正在測試其減肥針Saxenda。美國食品藥物管理局(FDA)和歐洲藥品局(EMA)目前都只批准了12歲以上的青少年使用此類療法。據報導引用美國臨床試驗網站ClinicalTrials登記資料顯示,禮來已開始招募10歲的二型糖尿病兒童進行試驗。公司高管也證實確實在向這個領域投入進行創新,以解決所有受影響人群的問題。與此同時,諾和諾德也正在6歲兒童的身上測試其減肥針Saxenda。據了解,Saxenda的主要成分為利拉魯肽(Liraglutide),與減肥神藥中的司美格魯肽(semaglutide)同是GLP-1受體激動劑。諾和諾德的發言人表示,由於定於11月2日公佈第三季業績,公司正處於靜默期,暫無法就試驗細節置評。但無論哪種藥物最終獲得批准,都將成為全球供低齡患者使用的首個GLP-1減肥藥物。到目前為止,美國FDA和歐洲EMA都只批准了12歲以上的青少年使用此類療法。對於製藥商來說,向兒童供應肥胖症藥物有望進一步增強他們的營利能力。本周稍早,高盛集團預測稱,到2030年GLP-1藥物的市場將達到1000億美元。如果這一數字計入對兒童的銷售額,將獲得進一步的提升。

夏日減重好時機 選擇合法減肥藥迎接蜜曲線
炎夏來臨,想到海邊或泳池消暑一下,低頭看看自己身材卻上不了檯面,不禁懊惱,每天都努力地克制食慾、少吃多動,怎麼瘦就是瘦不下來?難道減重也有撞牆期?知名整形醫美集團鄒政家醫師指出,吃太少達不到基礎代謝率,長期下來容易造成生理機能出狀況,影響身體健康,日後一旦回復正常飲食,更會發生體重反彈之溜溜球效應,體重與脂肪便開始不受控制!想要告別脂肪,應了解體重失控成因,並選對享「瘦」方法,就能輕鬆秀出超HOT線條!「腦饞」救星 同步控制飢餓大腦及情緒飢餓加速減重效率鄒政家醫師提到,「飲食行為是體重失控的關鍵原因之一,多數人認為,熱量消耗大於攝取就能減重,卻不一定了解自身進食行為與能量消耗的類型。」而口服減重藥物,特別對情緒進食型和食慾失控型肥胖有不錯的效果,可同時降低飢餓感及食物渴望,進而使體重減輕。根據臨床試驗的結果,有 85% 的受試者在使用後第 56 週內減輕了至少 5% 的體重。同時,已獲得美國 FDA、歐盟 EMA 以及台灣衛福部的核准上市。減重利器 從根本抑制食慾塑造輕纖感鄒政家醫師補充,若肥胖是因食慾過盛導致攝取過多熱量,可選擇減肥筆,其透過抑制食慾的GLP-1類似物,讓人產生飽足感並減緩胃部排空速度,來降低進食量。對於那些不想依靠手術抽脂來減重的人,可以經過專業醫師的全面評估後,使用GLP-1類似物藥物進行夏日減重管理,並結合飲食習慣的調整,可以進一步加速減重效果。「蜜曲線」最後養成,音浪脂雕成就迷人外表、窈窕體態即使透過飲食習慣、輔助藥物配合,順利讓體重及脂肪降低,但對於特定部位的脂肪是無法消除的,例如小腹、上臂的掰掰肉和大腿內外側等。傳統抽脂手術因破壞性大,修復期較長,愛美人士常因出血量多、疼痛度高、術後腫脹及瘀青多日不退等情形,而裹足不前。知名整形醫美集團陳依凡醫師提到,近年來抽脂儀器不斷的更新,與傳統抽脂手法大不相同,新一代音浪脂雕安全性高、恢復期短,特別針對骨架較小的亞洲人改良設計。音浪脂雕利用直徑僅0.9mm的超微細超音波探針溶解脂肪細胞,同時保護周圍組織完整。此外,由於音浪脂雕之超音波探針極小,可選擇性融化脂肪組織,有利於作臉部抽脂手術,連最難減的雙下巴,都能讓皮膚不平整之副作用降到最低,從臉到身體都能進行全方位脂雕,讓您實現窈窕迷人的蜜曲線夢想。知名整形醫美集團鄒政家醫師(左)、陳依凡醫師(右)。留意三大原則,慎選衛福部認證診所,安心享「瘦」免煩惱無論用哪種減重方式,需先留意以下原則:吃超過基礎代謝率:每餐熱量不低於基礎代謝率,並搭配健康飲食內容,讓自己瘦得健康也不容易復胖。不要只看體重:減重除了定期觀察體重之外,也要全面了解身形變化及體脂變化。不要快速減重:給自己訂個時間(最好是3-6個月為一循環),避免使用速效及極端的減重方式反而失了健康。陳依凡醫師最後提醒,在接受治療前,慎選衛福部認證診所,並留意診所之療程項目應使用原廠認證正貨,安全更有保障,更重要的是進行前都應先充分諮詢專業的醫師,由醫師來建議專屬的方案,方可使減脂成果更加理想。

「瘦瘦筆」疑似引發輕生念頭! 歐盟宣布展開調查
瘦瘦筆近年在減肥圈爆紅,然而歐洲藥品管理局(The European Medicines Agency ,EMA)近期表示,已接獲冰島通報,1例使用抑制食慾的胰妥讚(Ozempic)後導致出現自殺念頭、1例使用善纖達(Saxenda)想自殺、另1例使用善纖達出現自殘想法,將對此展開調查。名人效應 減肥針全球短缺名人在社交媒體上大量分享減肥貼文,吸引民眾跟風。目前善纖達和Wegovy已獲得減肥核准和許可。Ozempic適用於糖尿病患者,有助於控制血糖和體重。隨著民眾購買填充式減肥針,全球都出現短缺狀況。綜合外媒報導,胰妥讚為GLP-1受體促效劑,主要成分為semaglutide(索馬魯肽),核准用於治療第2型糖尿病;而善纖達含有類似的成分liraglutide(利拉魯肽),核准用於長期體重管理。兩者均由諾和諾德(Novo Nordisk)製造,由於許多非糖尿病患買來用於減重,經常處於全球缺貨狀態。EMA表示將針對善纖達、Wegovy、胰妥讚及其他類似減重藥物進行安全評估。目前歐盟藥物產品訊息中並未將自殺行為列為副作用,相關產品的安全性將由「藥品監測暨風險評估委員會」(Pharmacovigilance Risk Assessment Committee, PRAC)進行評估,日後將考慮是否將審查範圍擴大到「類升糖素胜肽-1受體促效劑」(GLP-1 receptor agonists)的其他藥物。諾和諾德對此回應,患者安全是重中之重,非常重視所有不良事件的報告。GLP-1受體促效劑應用於治療第2型糖尿病已有超過15年的歷史,用於治療肥胖症也有8年的歷史。從大型臨床試驗項目和上市後監測收集的數據中,並無證據顯示其藥物與自殺自殘傾向存有關聯。諾和諾德強調會持續監測正在進行的臨床試驗和實際使用其產品的數據,並與當局密切合作,以確保患者安全和向醫療保健專業人員提供足夠的信息。美國的善纖達處方資料包括建議監測患者是否有憂鬱或自殺念頭,若出現症狀時應停止用藥。在成人臨床試驗發現,服用該藥物的在3,300多人中有9人報告有自殺念頭,而服用安慰劑的1,900多人中只有2人有自殺意念;至於兒科臨床試驗中,125名研究對像中有1人因善纖達自殺而死亡。處方資料稱「沒有足夠的信息來確定與善纖達的因果關係。」美國食品和藥物管理局(The Food and Drug Administration ,FDA)2017年核准Ozempic用於治療糖尿病,並於2021年核准Wegovy用於減肥。官方表示,將繼續檢視獲核准藥品後續的安全性,並規劃檢測和風險評估系統,一旦發現新的警訊,將採取相關應對措施。常見減肥藥7大副作用專家提醒,減肥藥應與健康飲食和運動並用,而且所有藥物都有潛在副作用。部分藥品的仿單已將自殺念頭列入可能的副作用,建議使用者注意自己的情緒、行為、想法、感覺是否出現改變,並盡速尋求醫療協助。噁心嘔吐頭痛腹瀉便秘腹痛疲倦健康醫療網提醒您:自殺不能解決問題,你我都是自殺防治守門人。安心專線:0800-788-995(0800-請幫幫-救救我)張老師專線:1980勇敢求救並非弱者,您的痛苦有人願意傾聽,生命線專線:1995原文出處:Weight-loss jabs investigated for suicide riskEuropean regulators probe risks of suicidal thoughts in users of popular weight-loss medications

長期使用3C產品 嚴重恐引起偏頭痛
隨著科技的進步,3C用品成為了日常所需,無論是工作、學習、娛樂、交際等都會使用到3C,但你知道嗎?長期使用3C,不僅會用眼過度,還可能因為長時間低頭,使得肩頸肌肉僵硬而壓迫神經,引起慢性發炎,就會導致偏頭痛。偏頭痛的原因?陳信宏醫師說明,偏頭痛的機轉目前還不是很明確,但這幾年發現周邊神經或中樞神經的末端過度敏感,會有較大的機率引發頭痛。偏頭痛的原因有很多,像是飲食、壓力、睡眠、天氣變化、吃到刺激性食物、荷爾蒙改變或肌肉過於緊繃等因素,都有可能會產生偏頭痛。而偏頭痛通常有遺傳性,根據研究顯示,父母一方有偏頭痛,子女遺傳機率約4~5成,若是父母雙方都有偏頭痛,機率則高達2/3。偏頭痛第一次發作的年齡大概落於15~25歲,而好發年齡則是在30~50歲。臨床觀察發現,女性發生偏頭痛的比例是男性的三倍左右,最主要是因為女性賀爾蒙變化(如:青春期、生理期、懷孕或更年期等),有7成的女性偏頭痛的發作時間與經期有相當的關連性。除此之外,過度勞累或是生活作息不定的人,也較容易產生偏頭痛。根據目前新的研究顯示,肥胖的人機率也比較高,可能是因為運動量少,加上肥胖導致體內發炎物質較多有關,才較容易引發篇頭痛。想解決偏頭痛,有哪些治療方式呢?陳信宏醫師表示,目前治療偏頭痛最主流的方式就是藥物,口服藥物以急性止痛藥為主,因為偏頭痛大多都是陣發型,情況不嚴重者(一個月出現1~2次頭痛情形)就可以使用藥物,但若是發生頻率太高,就要搭配使用其他預防性藥物,例如:抗憂鬱劑、乙型阻斷劑、妥泰等。對於口服藥效果不好、嚴重或慢性偏頭痛的人,可以施打神經阻斷針、肉毒桿菌素或CGRP單株抗體注射等方式來改善偏頭痛。若是以上治療效果都不好的人,則是建議可讓專門醫師評估是否適合接受微創手術治療,去除長期刺激壓迫周邊神經的肌肉血管,使神經恢復健康,能有效改善過度敏感、降低或預防偏頭痛的發生。肉毒桿菌素不僅能用於醫美除皺,還能治療偏頭痛!陳信宏醫師指出,因長期姿勢不良而導致偏頭痛的3C族群,幾乎都會有肌肉過於緊繃的問題,所以要放鬆肩頸區域的肌肉(如:斜方肌、胸鎖乳突肌等)才能改善頭痛問題,將肌肉放鬆後較不會壓迫神經導致發炎而引發頭痛,能定期施打肉毒桿菌素來緩解頭痛,同時也會感覺肩頸比較不會那麼僵硬了。此外,使用3C一定要適時休息、做些舒緩活動,對於肌肉緊繃都能有些微的改善效果,還能透過物理治療或是舒緩按摩等方式,來放鬆肌肉、舒緩頭痛。肉毒桿菌素除了運用在醫美上,經多年研究證實,還能用於治療慢性偏頭痛,肉毒桿菌素治療偏頭痛的原理有兩個,一是肉毒桿菌素能抑制神經末梢的傳導物質「乙醯膽鹼」的釋放,進而使緊繃的肌肉放鬆,當肌肉被放鬆後就不會壓迫神經,此外肉毒桿菌素還能抑制發炎傳導物質,而達到緩解疼痛的效果。肉毒桿菌偏頭痛治療時間約10~20分鐘,在術後1~2周就能感受到治療效果,但少數較嚴重的人可能要治療1~2次才會有明顯效果,建議3個月施打一次、連續施打3個周期,標準治療劑量為155單位(實際治療劑量會依個人體質和問題嚴重程度而有所不同),醫師會根據患者疼痛部位、肌肉緊繃處或壓迫的神經點施打肉毒桿菌素,就能有效減少偏頭痛發作的頻率以及疼痛度。在韓國相當受歡迎的新一代「亞洲肉毒」(韓國俗稱:彩虹肉毒),由韓國知名藥廠經過多年研發,透過與西方接軌的先進HIPURE™專利純化技術,再利用SEC粒徑篩析層法進行過濾,只保留高純度>98%的大分子900KDa的肉毒桿菌素,且經過美國FDA、歐洲EMA和台灣TFDA三重認證,也是目前眾多韓國肉毒品牌中率先獲得多個國際第三方的嚴格認證批准,效果媲美老字號經典肉毒品牌,且價格親民,相當適合需要施打大劑量的人,性價比高且兼具效果與安全。醫師小叮嚀慢性偏頭痛患者應保持正常的生活作息,避免熬夜和過度勞累,才能有效預防偏頭痛發生。現代人3C不離手,因此普遍有肩頸痠痛文明病,一定要適當的休息與伸展讓肌肉舒緩,就可以減少偏頭痛發生的機率。陳信宏醫師特別提醒,偏頭痛是一種複雜和反覆發作的一個疾病,建議尋求擅長處理偏頭痛的醫師做診治,才能有效緩解頭痛問題。(文章授權提供/醫美時尚)更多有關《醫美時尚》:www.dr-beauty.net

荷蘭紅燈區改「大樓化經營」遭歐盟藥管局反對 市長反嗆:性工作者永遠不會消失
荷蘭的阿姆斯特丹擁有合法紅燈區世界聞名,吸引不少觀光客到訪一探究竟,但上個月阿姆斯特丹宣布,將計畫性關閉線有紅燈區的酒吧和餐館,並禁止在紅燈區吸食大麻,將這些店家移到新商辦大樓中,成立系統性情色中心,但不只新地點附近居民反對,連歐盟的藥品管理局都站出來說話,讓阿姆斯特丹市長表示,「性工作者屬於阿姆斯特丹,永遠不會消失」。阿姆斯特丹市府公布三個地點做為新紅燈區大樓,但也引發附近居民強烈反對。(示意圖/翻攝自pixabay)據《BBC》、《衛報》報導,荷蘭的阿姆斯特丹上個月宣布,計畫將協助原本紅燈區的酒吧與餐館,移動到新規劃的紅燈區大樓經營,這樣的情色中心計畫可以容納百名性工作者,裡面有酒吧、餐廳、聲色場所等,並公布可能的三個地點。但卻造成三個地點的居民不悅,不想社區附近成為色情集中地,而歐盟的歐洲藥品管理局(European Medicines Agency,EMA)也跳出來反對,認為情色中心設在靠近藥品管理局附近,恐會給附近地區帶來負面影響。但阿姆斯特丹市長表示,哈賽瑪(Femke Halsema)受訪表示,EMA大樓與預計規劃的情色中心至少有一公里,並表示要打造一個「有格調、人人都不會羞於造訪的色情中心」,擺脫紅燈區是罪犯與受害女子聚集地的傳統形象,並表示「性工作者屬於阿姆斯特丹,永遠不會消失」。

康霈局部減脂新藥二期試驗獲美FDA核准 股價聞訊大漲15%
康霈生技(6919)公告旗下新藥用於減少皮下脂肪(非手術局部減脂)CBL-514二期臨床試驗已獲美國FDA核准執行,此臨床試驗預計於美國、加拿大和澳洲共100位中、重度腹部皮下脂肪堆積受試者。2024年第二季取得臨床統計結果,進行中的授權談判已在持續進行中,今日盤中股價一度大漲15%,股價衝上興櫃以來最高價195.5元。康霈表示,美國FDA針對CBL-514減少皮下脂肪的三期臨床試驗主要評估指標是減少腹部皮下脂肪堆積等級(AFRS)之療效,因此該臨床改用核磁共振更精確的評估治療後減少的皮下脂肪量,以便模擬並取得產品未來關鍵三期臨床試驗的試驗設計條件。若本試驗案完成且主要終點達標,CBL-514將於2024年啟動減少皮下脂肪之全球多國多中心三期樞紐臨床試驗申請。此次FDA核准執行的二期雙盲臨床試驗主要目的為評估CBL-514注射劑用於減少皮下脂肪的療效、安全性與耐受度;將招募100位中、重度腹部皮下脂肪堆積的受試者,試驗分為CBL-514組與安慰劑組。此試驗是多國多中心、雙盲、隨機分配、安慰劑組對照的臨床試驗,且為加快收案速度,將於美、加、澳洲3國進行收案,試驗中心包含3國多位全球知名的PI加入,可同步為產品推進三期樞紐試驗與未來上市做準備。預計今年Q2開始收案,並計畫在2024年Q2取得臨床統計結果。此外,康霈進一步表示,CBL-514目前進行中的授權談判仍將持續,不需等到二期臨床試驗結束。康霈執行長凌玉芳表示,CBL-514注射劑是一種505(b)(1)全新小分子新藥,能誘導脂肪細胞凋亡,可經由注射方式精準減少治療部位脂肪,且不會造成其他組織細胞壞死或損傷,也不會對神經系統、心血管或呼吸中樞造成副作用。根據Grand View Research 2021年調查,2030年全球醫美市場預估為3321億美元;Deloitte中國身體塑形市場行業發展白皮書推估,全球局部減脂市場將超過1000億美元,且現有治療方式療效不佳或副作用大。目前局部減脂75~80%採用侵入性的外科手術,包含抽脂手術與腹部整形術,但外科手術具有嚴重副作用與後遺症,以及致死的高風險。而局部減脂產品的主要用途為減少治療部位的皮下脂肪而非減輕體重,目前局部減脂 75-80% 採用侵入性的外科手術,包含抽脂手術與腹部整形術,不過外科手術具有副作用與後遺症等。凌玉芳表示,並非所有三期臨床都可以申請新藥查驗登記(NDA),關鍵三期臨床試驗,才是攸關一個新藥最後能否獲得美國FDA或歐盟EMA批准上市的臨床試驗,為了降低風險,要求至少要有一個雙盲臨床二期試驗在療效指標達到主要終點統計差異,且與試驗設計高度模擬並取得更多樣且充分的療效數據,以大幅提升未來樞紐試驗成功達標的可能性。

國光生加速國際代工腳步 拚年營收破20億
國光生(4142)11日召開董事會通過第3季財報,受惠訂單成長、生產排程優化,Q3營收再創單季歷史新高,且Q1至Q3累計營收達16.6億元,淨利2.3億元,EPS 0.54元,超越2021全年營收數字。國光生表示,因應下半年出貨的傳統旺季,提前生產、提早出貨,得以提前到Q2開始,隨著製程優化及加速國際代工腳步,將逐步實現季季出貨,年頭旺到年尾的目標。展望明年,除了積極開拓流感疫苗成品及原液外銷的國際市場外,在CDMO部分,天道委託代工產品在第二條自動化產線生產,近日通過歐盟EMA針對新產線的查廠認證,明年委託代工產量可望大幅成長。國光生指出,今年流感疫苗成品和原液外銷生產、出貨時間都提早第二季開始大量出貨。第四季仍有大陸流感疫苗交貨、台灣公費流感疫苗追加訂單,及新增CDMO製程開發業務等,全年營收突破20億元可望達標。國光是台灣唯一加入WHO所屬國際製藥生產聯盟IFPMA的流感疫苗廠,可同步取得WHO的全球流感病毒監測資訊,再加上自主成立流感病毒選株小組,累積多年經驗,對流感病毒株預測日益精準,生產排程得以提早。 今年在流感疫苗成品和原液外銷生產、出貨時間,都較去年早,Q2即開始大量出貨,提前生產加上出貨順利,都具體顯現在營收數字上。未來也將透過提早生產、持續優化製程,讓出貨旺季提前成為常態。展望明年,國光生除天道委託代工產品通過歐盟EMA查廠認證,出貨大幅成長,還有多個CDMO製程合作開發案洽談中,明年可望承接小量、多樣化的代工業務。
男子接種AZ發生「毛細血管滲漏症候群」 核予救濟金40萬元
衛福部疾病管制署公布最新疫苗受害救濟審議結果,共有5案獲得救濟,其中一名台中市60多歲張姓男子,接種AZ疫苗後發生「毛細血管滲漏症候群」,經專家審議,無法確定與疫苗之關聯性,核予救濟金40萬元。疾管署發言人莊人祥說明,此為目前已審議新冠疫苗相關案件中,首例毛細血管滲漏症候群個案。根據疾管署最新公布衛福部預防接種受害救濟審議小組(VICP)第188次會議紀錄,共討論70名個案,其中6案獲救濟金,分別為5案接種新冠疫苗、1案接種卡介苗,依據「預防接種受害救濟基金徵收及審議辦法」,分別核予救濟金1萬至40萬元。本次審議結果中,一名台中市60多歲張姓男子,接種AZ疫苗後出現不良反應,經醫師診斷為毛細血管滲漏症候群,VICP審議結果為「無法確定與接種疫苗關聯性」,依規定核予救濟金新臺幣40萬元。莊人祥指出,目前已審議的新冠疫苗相關案件中,此為首例接種後出現毛細血管滲漏症候群的個案。毛細血管滲漏症候群(capillary leakage syndrome,簡稱CLS)是一種罕見的血液疾病,恐引發多重器官衰竭。台北榮總血液科醫師柯博伸說明,身體遭受外在刺激時引起的免疫反應,不正常的細胞激素分泌,微血管通透性上升,導致液體滲出,在各組織之間流動,可能引發下肢水腫、呼吸喘或呼吸困難、體重增加、腹水等症狀。歐盟藥品管理局(EMA)去年6月宣布,將毛細血管滲漏症候群增列為AZ疫苗的副作用。柯博伸指出,施打疫苗、癌症腫瘤或其他感染因素,都可能引發毛細血管滲漏症候群;屬於疫苗接種的罕見副作用,臨床上極少遇到。
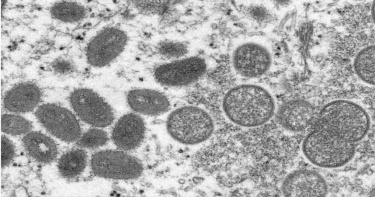
猴痘口服抗病毒藥來了!供重症及免疫低下確診個案使用
疾病管制署(以下稱疾管署)今(28)日表示,我國向國外採購之猴痘口服抗病毒藥物tecovirimat,已於昨(27)日晚間運抵臺灣,將於完成通關及驗收程序後配撥該署各區管制中心。該藥物將由醫師評估治療效益與風險,充分告知病患並獲得同意後提出申請,經審核通過後提供重症及免疫低下確診個案使用。(圖/指揮中心提供)疾管署指出,依據世界衛生組織(WHO)及歐洲疾病管制中心(ECDC)等單位之建議,大多數猴痘患者不需要特殊治療,以輸液治療與維持營養等支持性療法為主,以減輕症狀和併發症。口服抗病毒藥物tecovirimat建議使用於猴痘確診且病情嚴重之病患或免疫低下者。疾管署說明,tecovirimat經歐洲藥品管理局(EMA)核准使用於治療正痘病毒屬之天花、猴痘及牛痘;美國食品藥物管理局(FDA)核准使用於治療天花,美國疾病管制與預防中心(CDC)專案核可使用於治療因猴痘病毒感染惡化為重症或有重症危險因子之高風險患者,以降低死亡機率。我國衛生福利部食品藥物管理署已於今年7月13日同意依據藥事法第48條之2規定,核准其專案輸入。疾管署強調,猴痘已於今年6月23日公告為第二類法定傳染病,目前累計通報13例疑似病例,其中2例境外移入確診病例,感染國家為德國及美國,餘11例已排除;另自 6月30日起,將具有本土或不明感染源猴痘個案之49個國家旅遊疫情提升至「第二級:警示(Alert)」。該署提醒,國人若前往該些國家,應避免可能與不特定人士密切接觸之社交活動等高風險場域,返國入境時如出現發燒、皮膚病灶如紅疹、丘疹、水泡或膿疱等疑似症狀,應主動告知航空公司人員及機場港口檢疫人員,並儘速就醫,告知醫師旅遊史及接觸史。相關資訊可至疾管署全球資訊網( https://www.cdc.gov.tw )或撥打國內免付費防疫專線1922(或0800-001922)洽詢。
接種Novavax恐出現嚴重過敏 美警告過敏者切勿施打
歐盟藥品審查機構「歐洲藥品管理局(European Medicines Agency,簡稱EMA)」14日證實,施打Novavax疫苗可能出現「嚴重過敏」副作用,該疫苗於13日獲得美國監管機構的授權,其在美國的產品標籤警告,對疫苗成分過敏者,不要施打此疫苗。美國監管機構警告,對疫苗成分過敏者,不要施打Novavax疫苗。(示意圖/unsplash)路透社報導,歐洲藥品管理局(EMA)將更新疫苗的產品訊息,增加皮膚異常及減少知覺的副作用。根據歐洲疾病預防和控制中心(European Centre for Disease Prevention and Control,簡稱ECDC)的數據,自去年12月推出Novavax以來,迄今為止,歐洲僅使用了250,000劑Novavax疫苗(歐洲名為「Nuvaxovid」)。歐盟公布,施打Novavax新冠疫苗有嚴重過敏副作用後,Novavax與其他新冠疫苗製造商的股價,在早盤交易中,下跌20.3%至55.72美元(約新台幣1,668元),其中Novavax的股票波動較大。

新加坡推能源多樣化 將從寮國「進口水力發電」…電網橫跨這東協4國
新加坡政府日前宣布與寮國簽署為期2年的初始購電協議,屆時從寮國產出的最高100百萬瓦(MW)再生能源,將透過現有電網輸送至新加坡,而該計畫也被視為實現「東協電網」(ASEAN Power Grid)的探路工程,以及高達95%能源仰賴進口天然氣的新加坡,跨出能源多樣性的下一步。新加坡20年前推動能源轉型,以及2021年啟動「2030年綠色計畫」後,雖將主要能源的供應類型從石化轉為天然氣和太陽能等再生能源,以滿足轉型需要和完成碳中和目標,並預期2030年底可讓太陽能發電量達到總耗電量的3%,但同時也預期到過於仰賴從印尼、馬來西亞進口的天然氣能源,因此在天然氣和太陽能外,推動「區域電網」和如氫氣的其他「新興低碳替代方案」。而新加坡這次從寮國購買的「水力發電」也是新國首度進口再生能源,也代表「寮國—泰國—馬來西亞—新加坡電力整合計畫」(LTMS-PIP)項目和「東協電網」正式啟動和探路。新加坡能源市場管理局(EMA)表示,本次與寮國達成的購電協議,將能替大約14.4萬個四間房供電1年的時間。依照新加坡政府規劃,該國要在2035年進口4千百萬瓦的低碳電力,並占總能源供應約30%,以實現低碳、再生能源發展目標,更重要的是有助於「強化區域國家的能源合作」,尤其氣候變遷以及俄烏戰爭影響,不只電力、天然氣價格全面上揚,各類能源供應與物價都深受其害,今年5月的核心通膨更飆至3.6%,顯示出能源多樣化的重要性。此外,寮國國內的89座發電廠中,有高達78座為水力發電廠,並出口柬埔寨、泰國、越南與緬甸等國家共6千兆瓦,目前也和新加坡商討2028年將太陽能電力傳輸到新加坡的計畫,如果順利完成將成為目前已知全球規模最大的再生能源輸送項目。

毛孩用藥卡關1/高嘉瑜掀「潘朵拉之盒」後 獸醫:還有八成問題未解
立委高嘉瑜日前質詢一起寵物用藥,質疑獸醫師違法使用標靶藥物,意外掀起寵物用藥的「潘朵拉之盒」,也惹來大批飼主強烈抨擊。事後高嘉瑜為了平息這股「野火」,立刻找來相關單位研商,並獲得農委會同意適度鬆綁無藥證的動物用藥輸入門檻。獸醫師強調,這是寵物用藥的一小步,還有八成的用藥瓶頸需要克服。5月2日,高嘉瑜邀集了獸醫師公會全國聯合會、北高獸醫師公會主要幹部、農委會動植物防疫檢疫局副局長徐榮彬和動保行政監督聯盟何宗勳等人,協調放寬現有動物用藥合法管道,會中達成從寬函釋無許可證(無藥證)動物用藥進口門檻,及加速用藥申請的行政審查時間。消息一出不少飼主不吝給予掌聲與鼓勵,但也有人不買單,因為向來反對釋出「調劑權」的藥師並未與會。雖然目前合法動物用藥逾300種,然而其中只有百餘種符合「寵物」用藥,未來適用於貓狗的藥品還是屈指可數。一名在台北執業的獸醫師透露,獸醫界用藥大致分為有藥證動物藥和人用藥、以及沒有藥證動物藥和人用藥等四大類。他列出目前尚未合法的獸醫常用治療藥物,包括了心臟病、內分泌、腫瘤化療和腎衰竭等至少十多種藥物,其中這次高嘉瑜提到爭議用藥「palladia」就在其中,屬於第三種「沒有藥證的動物用藥」;另一名在場的獸醫無奈說,「當初在學校時用的都是這些,執業後才知道,這麼用藥會被檢舉到死啊!」高雄市獸醫師公會常務理事蕭序諺表示,獸醫並非不想使用合法的動物藥品,但藥證申請上困難重重,光是在防檢局的登記證申請就非常嚴格,時間一拖三至五年,且台灣寵物數量約三百多萬隻,美國寵物市場約八千萬隻,日本約兩千萬隻,台灣市場規模相當小,且申請後也並非適用所有寵物,因此根本沒有藥商想申請藥證。嘉義市動物守護協會理事長吳育才指出,每當發生獸醫或藥商被檢舉使用或販賣人用藥,緊接而來的就是藥品斷貨潮或漲價潮。(圖/嘉義市動物守護協會提供)蕭序諺指出,此次為獸醫開通無藥證動物藥品的窗口,然而人用藥物才是動物用藥的主要來源,在國外獸醫治療寵物的八成以上藥物,皆為人用藥物,其中包括有藥證人用藥與沒有藥證的人用藥;但國內動物禁用人用藥品,而動物藥品又分經濟動物(牛羊雞豬等)與非經濟動物(犬貓兔等寵物),其中純寵物用藥不到100項,像是外用藥、滴劑等,而純動物用抗生素僅三種;而動物用人藥根據現行法規為「正面表列」,僅清單上的514項。因此像是破傷風藥、腫瘤化療藥物、心臟病、內分泌、腫瘤化療、腎衰竭、腎上腺皮質素等藥品,礙於未列入「獸醫師專案申請人用藥品治療動物之暫行替代品項」(人醫動物用藥)正面表列清單,延誤治療時程的黃金時間屢見不鮮,去年在立委陳亭妃協調之下,農委會防檢局已成立「動物緊急需用人藥治療平台」,讓獸醫師可以透過平台第一時間取得用藥。針對獸醫使用514項正面表列以外的人用藥品,蕭序諺指出,光就生理食鹽水來說,目前合法的動物用生理食鹽水只有500CC一種,但動物用食鹽水和人用成份並沒有不同,在治療動物時多數只要20CC,即使是化療也只要100CC,「500CC根本是逼我們只能選擇一種規格」,且還會有重複使用的污染風險。對此,執業十年的獸醫鍾沂勳建議,簡化藥商的藥證申請流程,增加寵物用藥許可品項,並建議經濟與非經濟用藥分離,避免歸類為非經濟動物的寵物用藥受限;蕭序諺則建議,若某種動物藥上市超過十年,並且取得美國食品藥品監督管理局(FDA)、歐盟藥品管理局(EMA)以及日本農林水產省(MAFF),三者其中兩者的動物藥品登記證,其安全性和普及性都有很高的代表性,農委會應該許可直接發給藥證。獸醫鍾沂勳建議,在無藥證動物用藥方面,可簡化藥商申請藥證的流程,增加進口意願,同時將經濟與非經濟動物用藥分離,增加適合寵物治療的藥品。(圖/吳婉瑜攝)

我新冠健康證明配合歐盟修正 未滿18歲民眾基礎劑有效期為365日
中央流行疫情指揮中心今(13)日表示,歐盟執委會指出,歐盟數位新冠證明(EU-DCC)中之疫苗證明,鑑於12歲以上民眾之追加劑雖已獲歐洲藥品局(EMA)核准,惟並非各國均已實施,因此修正基礎劑僅限於18歲(含)以上有效期限為270日,未滿18歲之民眾所持證明基礎劑有效期限仍為365日,並希望各EU-DCC成員國配合修改各國查驗程式。指揮中心指出,我國「數位新冠病毒健康證明查驗程式」( https://dvc.mohw.gov.tw/verifier-web )將配合於今日改版,此項修正不影響申辦平臺及已核發之數位證明,系統將自動判斷未滿18歲之民眾所持證明基礎劑有效期限仍為365日。指揮中心提醒,由於必須配合歐盟資料更正,各場所使用查驗程式,可透過重新連線至查驗程式網站,並清除使用者端的快取記憶,以利保持最新驗證邏輯。詳細數位證明申辦及驗證系統操作方式可以參考衛生福利部官網數位證明專區( https://covid19.mohw.gov.tw/ch/np-5345-205.html )。(圖/疾管署提供)(圖/疾管署提供)(圖/疾管署提供)

丹麥開歐洲第一槍 宣布開打「第4劑疫苗」連這國都想跟進
新冠肺炎持續在國際延燒,不少國家都出現新一波疫情高峰,由於變種新病毒株Omicron傳播力強又快,也讓不少國家再推完打第三劑疫苗後,決定推打第四劑,丹麥就是歐洲第一個將施打第四劑的國家,另外匈牙利也傳出將跟進。丹麥近日確診數每天都破萬例,且他們接種第2劑疫苗者佔全國五分之四,還有超過半數的人都已施打第3劑疫苗,但確診數依然居高不下,不過他們也發現住院率與死亡數下降與穩定,所以即使在確診數的狀況下,依舊重新開放電影院、劇場、體育館等等設施,丹麥的衛生部長修尼克(Magnus Heunicke)則指出,由於新冠病毒傳播力變得更廣,因此決定針對施打加強劑的民眾,提供第4劑疫苗,也成為歐洲第一槍,甚至考慮讓高齡族群也優先施打。而在丹麥宣布開打第四劑後,也傳出匈牙利即將跟進的消息。另外以色列、智利已開始接種第4劑疫苗。不過有防疫專家則警告,接種太多疫苗可能會損害身體抵抗病毒的能力,還可能會導致免疫系統疲勞。歐盟藥品監管機構(EMA)也對接種第4劑疫苗的必要性感到質疑,但現階段尚無足夠證據來支持打第4劑的有效性。