適應症
」 治療 台股 患者 減重 醫師
醫界自爆3/羊膜粉救半月軟骨「常遭拒賠」 膠原蛋白玻尿酸敷料也是
CTWANT日前報導醫界推薦可促進骨骼療癒「羊膜異體移植(粉劑生長因子)」自費醫材,涉及「必要性醫療」而頻遭保險公司拒賠,記者進一步調查,根據統計,此類羊膜粉、玻尿酸等浮出檯面爭議案不僅達數百件,還有膠原蛋白敷料、膠原蛋白基質、膠原粉、可吸收性止血粉、水性創傷敷料、癒合敷料、凝合劑等也是一大宗。根據金融消費評議中心的資料顯示,在交通、職災、跌倒等意外事件常出現的外傷、骨折等,以及運動風氣興盛帶來的膝蓋等運動傷害,以CTWANT報導案例來看,有些保戶接受醫生建議而使用「羊膜異體移植(粉劑生長因子)」,卻因涉及「必要性醫療」而頻遭拒賠之例,認為保險公司不需理賠羊膜粉費用、顧立關關節內注射案件,在整體實支實付險1550件中佔比達235件,該自費醫材費用達數萬元到十多萬元不等。而在治療切除內外痔、皮膚腫瘤,且在睡眠呼吸中止症、鼻中膈彎曲及雙側肥厚性鼻炎、腺樣體肥大、軟顎纖維化、打鼾、慢性扁桃腺炎、扁桃腺術後出血、鼻中膈造型手術、肥厚性鼻炎等治療中,因使用「膠原蛋白敷料、膠原蛋白基質、膠原粉、可吸收性止血粉、水性創傷敷料、癒合敷料、凝合劑」等無法獲保險公司理賠累計也約200多件。「有些自費醫材,公司理賠確實不像過往這麼快,會審慎評估」「常提醒保戶受傷、發生意外事故時,除了趕緊就醫,第一時間也最好記得通知服務的保險業務員,協助瞭解治療過程中,醫生建議的自費醫材項目,是不是真的能獲得實支實付險的理賠。」一名大型壽險公司資深保險從業人員告訴CTWANT記者。記者調查,有保戶因右膝內壁皺褶症候群住院治療,並接受膝關節鏡檢輔關節軟骨刮修手術,保險公司雖就住院理賠超過20.6萬元,但另有156,700元自費醫材費用則認為依保單條款無須理賠。CTWANT調查,保戶在接受治療膝蓋受傷、退化等所使用的「羊膜異體移植(粉劑生長因子)」,為保險公司實支實付險「拒賠」的一大項目,圖為半月軟骨示意圖。(圖/報系資料照)而這156,700元則是保戶在醫院用於右膝關節二次注射的羊膜絨毛膜異體移植物的費用,分別是84,000元及112,500元,目前醫界多認為羊膜異體移植物含有生長因子,理論上可促進軟組織癒合,調控發炎反應、減少疤痕組織生成,但也有醫界人士認為實際作用於人體之狀況,尚待臨床試驗證實,目前並無臨床試驗證實系爭材料有益於內壁皺褶症候群之治療,因此認為使用並非醫療常規,無醫療必要性。此外,還有保戶發生意外送醫急診,診斷出現右側眼眶緣撕裂傷約1.5公分,右側膝部撕裂傷約5公分,後又因下樓梯踩空受傷摔及右肩撞擊受傷疼痛,右膝挫傷、右肩挫傷到診所就診,接受「顧立關關節內注射、羊膜異體移植」等治療,但該醫材費用未獲保險公司理賠。根據金融消費評議中心顧問醫療的描述,認同保險公司無須理賠的判斷,主是是經查臨床學文獻,「顧立關關節內注射」之適應症「用於保守性非藥物治療無效及一般鎮痛劑治療無效之退化性膝關節炎疼痛,作用為增進關節營養、潤滑、吸震等,降低退化性關節炎的症狀」,並非屬外傷治療常規用藥。「羊膜異體移植」主要原理在於羊膜組織中含有豐富的生長因子和幹細胞,可以刺激受損組織的修復,以改善人體的自我修復能力和治癒過程,可應用在關節及其他疼痛問題的治療上,如關節炎或受傷退化的組織;適合對象為長期慢性疼痛、不適合開刀、血液狀況不良及已試過保守治療的案例上。醫界人士表示,顧立關(Synolis VA)是一種用於治療退化性膝關節炎的關節內注射玻尿酸產品,結合玻尿酸與山梨醇,能增加關節液潤滑、保護軟骨,適用於保守治療無效的膝骨關節炎患者,通常由醫師進行關節腔內注射;健保可給付傳統玻尿酸,而較新的長效型玻尿酸單次注射費用約自費數千元至數萬元不等,建議根據醫師評估選擇。

路上被搭訕! 苦主媽媽被騙買1物「吃到要洗腎」
近年出現越來越多不同的詐騙手法。有民眾控訴,媽媽在路上被陌生人搭訕,被誘騙購買「口服青草藥」,長期服用後身體出問題,嚴重到要洗腎,消息曝光後引發網路熱議。16日一名網友在臉書社團「爆料公社公開版」發文表示,媽媽在路上被人搭訕,對方推銷並誘使她購買「口服青草藥」,沒想到媽媽竟然吃到要洗腎。對此,原PO無奈提醒大家不要上當受騙,詢問是否也有人遇到相同的狀況。從原PO貼出的照片可見,原PO媽媽購買了大量藥品,分裝在白色塑膠罐中,外包裝相當簡陋,只有,瓶身不僅沒有藥品名稱,也沒有任何合法藥品許可證字號,只貼有服用時間與吃法。貼文曝光後引發熱議,許多網友紛紛留言表示「來路不明的東西為什麼要讓長輩吃呢」、「這種搭訕的幾乎都是詐騙沒錯」、「這是長期以來公共場所醫院,都有這種詐騙告知老人勿接觸就好了」、「沒有國家認證也敢吃 」、「都2025年了,為何還能被騙」、「就算知名藥廠或生技公司的產品,我也建議家人沒事不要亂吃,注重自己飲食跟規律作息比較實在」。據衛福部食品藥物管理署規定,合法藥品在其標籤、說明書或包裝上,都須依法清楚標示藥品名稱與許可證字號等資訊,並詳列主要成分及含量、用法用量、主治效能或適應症,以及副作用、禁忌事項與其他注意事項。此外,還需要標示廠商名稱及地址、製造日期、有效期限或保存期限、批號等資訊。衛福部也提醒,不要透過來路不明的管道購買藥品,若買到偽藥,不但花了冤枉錢,吃了還傷身體,得不償失。
新藥股大漲跌2/研發路漫漫「臨床失敗」即斷頭 授權訂單分潤看實績
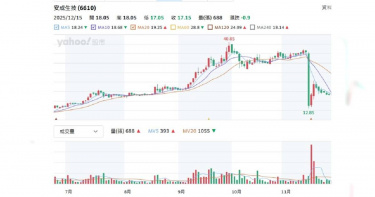
專注新藥研發製造個股中,近期股價大跌包括安成生技(6610)、合一生技(4743)等均以創新藥為核心,卻因臨床試驗失敗、終止部分藥物開發、營收挹注未明顯奏效等利空消息,影響股價受挫,投資人荷包大失血。CTWANT調查,安成生技2025年11月16日夜爆NORA520(用於治療產後憂鬱症/PPD)美國二期臨床未達標,給藥組與安慰劑差異無統計顯著性,股價隔日開盤36元跳水至12.85元,跌64.31%,觸發熔斷暫停交易。這是台股生技史上罕見單日之例;至周五的收盤股價逐漸回升到16.40元。安成表示,「本試驗為一項隨機、雙盲、安慰劑對照研究,納入93名成人女性重度產後憂鬱症患者,以1:1:1比例分組,三天住院口服治療。主要療效指標未達標,但精神健康領域存在高度未滿足需求;重申團隊將以謹慎科學態度,完成進一步分析後,以確保NORA520未來開發策略,合乎市場需求與法規指引除了NORA520 之外,研發管線中另一項藥物AC-203正進行全球第二/三期的臨床試驗,已在全球18個國家,35個試驗中心全面進行收案,預期於2026年第一季進行期中分析。安成生技2025年股東會通過合併杜康藥業,圖左二杜康董事長陳志明,中為安成生技董事長吳怡君,右二為安成生技總經理蔡承恩。(圖/報系資料照) 合一生技則是8月28日公告終止肝癌藥OB318開發,股價隔天雖從75.6元下跌到收盤價70元,9月初漲到78.5元,之後逐漸下滑到11月下旬的57.3元;接下來則是上漲到72.7元;12月7日中國國家醫保局公布首版《商業健康保險創新藥品目錄》之後,股價再跌一波,到本周五收盤價58.2元。合一將在12月24日舉行第三季線上法說會,最新公告Bonvadis外用乳膏取得印度醫藥品監管機構(CDSCO)核准完全傷口適應症之醫材上市許可;「速必一」新藥(研發代號ON101)通過促進傷口癒合的外用製劑配方加拿大發明專利。先看合一官網刊登去(2024)年7月時的新聞內容,開盤跳空漲停來到185.5元,主要是受到糖尿病足潰瘍新藥「速必一」授權給中國華潤集團旗下華潤雙鶴藥業締結20年長約消息激勵,華潤雙鶴取得速必一在大陸市場的獨家銷售權,簽約金最高達3350萬美元(約新台幣10.98億元),以及後續合理產銷利潤、權利金等。只是,合一今(2025)年11月營收820.7萬元,較去年同期的949.1萬元,減少13.53%;累計營收9850.3萬元,較去年同期的1.06億元,減少7.58%;前三季虧損逾10億元,每股盈餘損失2.11元,股價一路溜滑梯。每一家公司對新藥開發都有前景與希望,但也都強調,「新藥開發風險高、時程長、不保證成功」,請投資人審慎評估。
新藥股大漲跌1/這二檔營收利多股價亮眼 「它」納入中國目錄成亮點
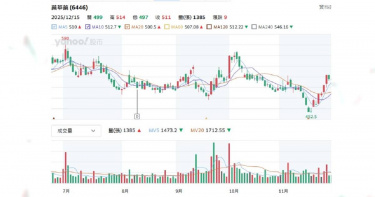
台股力拼站回28K,AI概念股仍是主旋律,大數據分析等科技導入生技醫療產業也加速新藥研發進程,臨床試驗數據一翻兩瞪眼好壞在眼前,CTWANT調查2025年股價亮眼上漲與慘跌共四檔新藥股,2026年展望是個個有希望,最關鍵的還是營收財報給證據。 先來看看最新一例,2025年12月7日中國國家醫保局公布首版《商業健康保險創新藥品目錄》,納入18家企業19款高值創新藥,聚焦CAR-T、雙抗、罕見病及阿茲海默症等超出基本醫保範圍的產品,研發PTS肺癌新藥的共信-KY(6617)子公司天津紅日健達康醫藥科技公告「治療中央型氣道阻塞產品-PTS302」,成為台股唯一上榜個股,消息曝光,股價從78.8元上漲到86.6元,旋即又短暫下跌86.4元,再逐步漲到15日收盤價90.5元,到這周連四跌、周五收盤價85元。 CTWANT調查,共信12月3日公布11月合併營收259.1萬元,年減12.5%,累計雖年增11.42%,但投資人擔憂目錄效應需時間轉化實際訂單。 至2025年12月15日止,觀察仁新醫藥(6696)、藥華藥(6446)個股股價變化,其均以創新藥為核心,近期受臨床進展、營運利多驅動,股價有所表現。仁新醫藥近一月從270元上漲到最高442元,近三月則從162元漲到周五收盤407元;藥華藥近一月從453元漲到最高519元,近三月則最高漲到559元。仁新醫藥專注罕見疾病新藥,子公司Belite Bio(美國納斯達克BLTE)Tinlarebant三期臨床於2025年12月1日公布,針對青少年斯特格病變臨床三期試驗(DRAGON)解盲之關鍵性數據亮眼,共收案104位青少年受試者,並成功達成主要療效指標。Belite董事長暨執行長林雨新醫學博士表示,「DRAGON最終試驗結果讓斯特格病變疾病治療迎來了歷史性突破,Tinlarebant將成為首個治療這種具威脅性疾病的潛在新藥,期盼藉此帶給無藥可醫的患者及其家屬治療新希望。」BLTE股價從今年初低點62.09美元,漲到近期的最高點156美元,「三期解盲成最大催化劑。」證券分析師表示。Belite規劃於2026年上半年與各國監管機構討論Tinlarebant的潛在後續計畫與新藥查驗登記申請(NDA)送件事宜,並向美國FDA遞交新藥查驗登記申請(NDA)。Belite宣布Tinlarebant抑制視網膜萎縮進展達預期,股價飆至新高,仁新持股 43.94%間接受惠,募資126億元不折價增資當日完成。仁新2026年關鍵為Tinlarebant FDA核准,預計上半年送NDA。藥華藥向美國FDA申請Ropeg新適應症「原發性血小板過多症(ET)」,目標2026上半年取證。圖左起為執行長林國鐘、董事長詹青柳、總經理黃正谷。(圖/CTWANT資料照)藥華藥旗下真性紅血球增多症(PV)新藥Ropeginterferon alfa-2b(Ropeg,P1101)用於新適應症罕病血癌藥銷售勁揚,股價高檔震盪,10月底完成向美國FDA申請Ropeg新適應症「原發性血小板過多症(ET)」送件,若順利獲准,最快有望於2026年上半年取得美國ET藥證,成為公司啟動第二成長曲線的重要動能。藥華藥11月營收15.5億元,月增10.63%,年增53.02%,已連續3個月刷新單月歷史新高;累計前11個月達137.11億元,較去年同期的86.02億元,成長59.38%;前三季獲利達35.69億元,年增翻倍,每股盈餘9.66元,賺近一個股本。根據CTWANT調查,藥華藥也正同時研發新款癌症藥物。此外,Ropeg筆型注射劑的補充性生物製劑查驗登記申請(sBLA)審查亦同步進行中。FDA已通知審查目標完成日(PDUFA date)為2026年2月14日。

藥華藥再捷報!Ropeg完成申請美國ET藥證 拚2026取證
藥華藥(6446)再報佳績,11月營收再創新高之外,旗下新藥Ropeginterferon alfa-2b-njft(Ropeg,即P1101)於美國申請原發性血小板過多症(ET)新適應症藥證進展順利,已完成與美國食品藥物管理局(FDA)的送件說明會議(AOM),預計2026年取證。藥華藥於12月8日以視訊方式與FDA審查官員召開ET藥證申請之AOM,AOM(Application Orientation Meeting)為公司提交藥證申請後,與FDA審查官員團隊舉行的首次正式會議。會中,公司向FDA審查官員深入說明申請文件架構、臨床效益摘要、藥物機轉及安全性等重點。透過AOM,公司得以引導審查官員在龐大的臨床資料中聚焦關鍵數據,並協助FDA在啟動實質審查前即可掌握送件資料的核心脈絡。藥華藥11月營收15.5億元,月增10.63%,年增53.02%,已連續三個月刷新單月歷史新高。藥華藥2025年10月底向美國FDA申請Ropeg的ET藥證,並已獲FDA確認,若於收件日起60日內FDA未通知其他意見,本案將依法於2025年12月29日正式進入實質性審查程序。 Ropeg為藥華藥自行發明生產的新一代創新長效型干擾素,至今已獲全球約50個國家核准用於真性紅血球增多症(PV)患者並上市銷售,包括歐盟、美國及日本等主要新藥市場,全球用藥人數及銷售穩健成長。持續拓展Ropeg新適應症,ET與PV同屬骨髓增生性腫瘤(MPN),病人數亦相近。

藥華藥大漲22元、4.85%!新藥創美FDA近30年 「首件」申請ET藥證
台股20日強彈收在27,426.36點,大漲846.24點,漲幅達3.18%;台積電漲60元收在1455元。新藥股中的藥華藥(6446)在最新公布Ropeg應用於治療ET的全球第三期臨床試驗「SURPASS ET」成果,邀請到競爭對手Incyte前總座Barry Flannelly擔任美國子公司獨立董事,喊出目標營收10倍成長,激勵股價收在475.5元,漲22元,漲幅達4.85%。藥華藥旗下真性紅血球增多症(PV)新藥Ropeginterferon alfa-2b(簡稱Ropeg, 即P1101)用於新適應症「原發性血小板過多症」(ET)的全球藥證申請,繼陸續完成中國、臺灣、日本ET藥證申請,近期更於美國時間10月30日完成美國ET藥證申請送件,為近30年來業界首度向FDA申請ET藥證,創下ET領域新藥里程碑,目標2026年取證。FDA已發函通知,若自收件日起60日內FDA未通知其他意見,本案將依法於2025年12月29日正式進入實質性審查程序。藥華藥執行長林國鐘表示,這是近 30 年來業界首度向美國FDA申請ET藥證,非常珍貴。Ropeg用於治療ET的第三期臨床試驗結果已充分顯示Ropeg對ET病患極具顯著臨床效益。目前ET的主要用藥是愛治(HU)和ANA,但其療效與耐受性仍十分有限。Ropeg不僅具有優於現行治療潛力,更有望成為第一個獲FDA核准可同時治療PV和ET的藥物,滿足MPN領域的醫療迫切需求,領航MPN市場。此外,藥華藥19日公布Ropeg應用於治療ET的全球第三期臨床試驗「SURPASS ET」成果,董事長詹青柳、執行長林國鐘表示,SURPASS ET是一項開放性、多中心、隨機分配、有效藥物對照之臨床三期試驗,以比較Ropeg與安閣靈(Anagrelide, ANA)做為二線治療對於ET之療效、安全性與耐受性。本試驗療程共12個月,並以受試者第9個月及第12個月均有療效反應為主要療效指標。另一方面,SURPASS ET更採用了Ropeg的快速遞增劑量方案(250mcg-350mcg-500mcg),以更高的起始劑量施打Ropeg,並更快施打到目標劑量。研究結果顯示,Ropeg組在持久臨床反應率方面明顯優於使用ANA的對照組(42.9% vs. 6.0%;p=0.0001),達到統計上顯著意義,展現了明確的臨床優勢。該研究成果於2025年美國臨床腫瘤學會(ASCO)年會中進行口頭報告,榮獲「Best of ASCO」年度精選論文肯定,並入選歐洲血液學協會(EHA)年會六大頂尖摘要之一,於最高榮譽的主會場(Plenary Session)發表,令醫師們印象極為深刻。SURPASS ET成果更於今年11月登上國際三大權威期刊之一《The Lancet》的血液學子刊《The Lancet Haematology》,不僅代表Ropeg在血液腫瘤治療領域的臨床價值獲得學術領域的關鍵肯定,也將成為未來臨床應用與治療指引的重要依據,並進一步提升Ropeg在血液腫瘤領域的國際能見度與學術影響力,更有助於後續藥證申請的審查和全球市場的拓展。

諦醫生技入圍世界ADC獎 技術平台與產品獲國際肯定
T-E Pharma宣布,旗下諦醫生技 (T-E Meds, Inc.) 成功入圍「第12屆世界ADC獎」之「2025 年最佳新藥開發者」獎項。諦醫生技從全球眾多競爭激烈的提名者中脫穎而出,成為全球僅六家的入圍公司之一,榮獲此項殊榮!「世界ADC獎 (World ADC Awards)」自 2014 年創立以來,已成為全球抗體藥物複合物 (ADC) 領域最具指標性的國際獎項,象徵ADC技術創新、研發潛力與臨床價值的最高肯定。其中的「Best New Drug Developer」(最佳新藥開發者),專門表揚ADC公司深具開發潛力且即將進入臨床的產品,肯定其在研發新穎性、差異化及實驗數據方面的優異表現。過程由業內資深專家評選,無論是入圍或獲獎,都象徵公司技術實力獲得國際認可,並展現其研發能力具備高度競爭力。聚焦 ADC/ARC 創新研發,打造領先平台諦醫生技是免疫功坊的姊妹公司,專注於抗體藥物複合物 (ADC) 與抗體放射性核種複合物 (ARC) 的創新開發。公司基於自主研發的「多臂鏈接體」(multi-arm linker) 技術平台,結合各式單藥或雙藥的藥物束 (mono- or dual-drug bundle) 及模組化的偶聯反應,可用於開發各式兼具高藥物抗體比 (drug to antibody ratio; DAR)、高產率、高純度及靈活載藥潛力的新一代 ADC 藥物,打造獨有且具特色的國際級抗體偶聯藥物平台。諦醫生技入圍世界ADC獎,技術平台與產品獲國際肯定。(圖片提供/諦醫生技)核心產品管線:TE-1146 與 TE-1182· TE-1146:為全球首款將來那度胺 (Lenalidomide) 分子偶聯於抗CD38抗體 daratumumab的新型ADC藥物,有潛力治療多發性骨髓瘤與其它相關適應症。臨床前研究顯示,其腫瘤毒殺能力優於現有臨床藥物組合,能以更低劑量達到更佳治療效果,兼具高效能與高安全性。今年1月,公司已將TE-1146未來在台灣、東南亞及紐澳地區的商業化權利,以新台幣2.7億元授權予友華生技;接著6月更獲得台灣財團法人醫藥品查驗中心認證為「新藥開發指標案件」,充分展現市場價值與臨床發展潛力。目前已完成大部分CMC製程開發與前期毒理試驗,預計於2026年上半年提交新藥臨床試驗 (IND) 申請。· TE-1182:是針對表達HER2之腫瘤 (如乳癌、胃癌、肺癌等) 所開發的雙載藥物 (dual-payload) ADC新藥,能克服腫瘤異質性與抗藥性挑戰,特別適用於 HER2 表現量較低或已產生抗藥性的後線治療。TE-1182不僅有潛力填補臨床用藥缺口,並為癌症病患提供更有效的治療選項。目前已完成多項關鍵研究,並持續推進臨床前評估,預計於2026年第四季提交IND申請,加速邁入臨床開發。邁向全球舞台,推動突破性療法諦醫生技此次入圍「第12屆世界ADC獎」之「2025年最佳新藥開發者」獎項,不僅展現公司在 ADC 創新技術與產品研發的堅強實力,更展現技術與產品具國際能見度與全球競爭力。公司將持續以先進平台技術推動候選藥物開發,致力為患者帶來更多突破性治療選擇,並加速臨床推進與全球市場布局。World ADC Awards2025官網:https://worldadc-awards.com/about/2025-shortlist/附表:諦醫生技領先 ADC 新藥開發管線:聯絡資訊若您有合作洽談需求或欲了解更多資訊,歡迎與我們聯繫電子郵件:bd@temeds.com 公司官網:https://www.temeds.com/ LinkedIn: https://www.linkedin.com/company/TEPharma/T-E Meds Shortlisted for World ADC Awards, Showcasing Global Recognition of Its Innovative Platform and PipelineT-E Pharma announced that its subsidiary, T-E Meds, Inc., has been shortlisted for the prestigious“Best New Drug Developer” category at the 12th World ADC Awards 2025. Selected from a highly competitive pool of global nominees, T-E Meds is one of six finalists to receive this distinguished honor. Since its launch in 2014, the World ADC Awards has become the most influential international recognition in the field of antibody-drug conjugates (ADCs), honoring breakthroughs in innovation, R&D potential, and clinical value. The“Best New Drug Developer” award specifically acknowledges ADC companies with strong development potential and assets approaching clinical stages, highlighting excellence in innovation, differentiation, and experimental data. Being shortlisted itself reflects global recognition and affirms a company's competitive strength in ADC research and development.Driving Innovation in ADCs and ARCswith a Leading PlatformT-E Meds, a sister company of Immunwork, is dedicated to the innovative development of ADCs andantibody-radionuclide conjugates (ARCs). Leveraging its proprietary multi-arm linker platform, the company integrates mono- and dual-drug bundles with modular conjugation chemistry to create next-generation ADCs. This platform enables product with a high drug-to-antibody ratio (DAR), high yield, high purity, and versatile payload capacity, establishing a distinctive and world-class ADC technology platform.(Photo/T-E Meds)Core Pipeline Highlights: TE-1146 and TE-1182· TE-1146:TE-1146 is the first ADC linking lenalidomide to the anti-CD38 antibody daratumumab, developed for the treatment of multiple myeloma and related indications. Preclinical studies have demonstrated superior tumor-killing efficacy compared with current drug combinations, achieving improved therapeutic outcomes at lower doses with both high potency and safety. In January 2025, T-E Meds out-licensed the commercial rights of TE-1146 in Taiwan, Southeast Asia, Australia, and New Zealand to Orient EuroPharma for USD 8.5 million. In June 2025, the program was further recognized by Taiwan's Center for Drug Evaluation as “A Key New Drug Development Project”, underscoring its market value and clinical potential. With most of the CMC development and preliminary toxicology studies already completed, T-E Meds is targeting IND submission in the first half of 2026.· TE-1182:TE-1182 is a dual-payload ADC targeting HER2-expressing tumors—including breast, gastric, and lung cancers—designed to overcome tumor heterogeneity and drug resistance, particularly in HER2-low or refractory settings. Addressing an urgent clinical need, TE-1182 aims to provide more effective therapeutic options for cancer patients.The program has completed multiple key preclinical studies and is advancing toward clinical readiness, with IND submission planned for Q4 2026.Advancing Toward the Global Stagewith Breakthrough TherapiesT-E Meds' nomination for the 12th World ADC Awards – Best New Drug Developer underscores the company's robust innovation capabilities and growing global recognition in ADC technology and drug development. With its advanced platform and pioneering pipeline, T-E Meds remains committed to delivering breakthrough therapies, accelerating clinical advancement, and expanding its global footprint.World ADC Awards 2025:https://worldadc-awards.com/about/2025-shortlist/T-E Meds’ Leading ADC Pipeline:Contact InformationForpartnership inquiries and further information: E-mail:bd@temeds.comWebsite:https://www.temeds.com/LinkedIn: https://www.linkedin.com/company/TEPharma/
快打疫苗!上週增63例流感重症、9人死亡 疾管署示警:仍處流行期
依據疾管署監測國內呼吸道傳染病情形,今年第44週(10/26-11/1)類流感門急診就診計10萬6,829人次,較前一週下降4.9%,另上週(10/28-11/3)新增63例流感併發重症病例(26例H1N1、32例H3N2、3例A未分型、2例B型)及9例死亡(5例H1N1、4例H3N2),國內流感疫情仍處於流行期。疾管署表示,全球流感病毒陽性率於近期處低點穩定,流行型別以A型為多,亞洲鄰近國疫情上升,主要流行型別為A(H3N2),其中日本、韓國、中國近期活動度及陽性率皆上升趨勢,香港持續處高點;歐洲及北美洲地區亦呈上升趨勢,流行型別則為A(H1N1)及A(H3N2)。疾管署說明,國內新冠疫情目前處低點波動,第44週新冠門急診就診計1,398人次,與前一週相當,主流變異株為NB.1.8.1。全球近期新冠病毒陽性率呈上升趨勢,西太平洋、歐洲、及非洲區署陽性率增加;鄰近國家/地區中國、香港、日本、韓國、泰國疫情下降或處低點,另英國疫情呈下降趨勢。目前流行變異株以XFG占比最高,其次為NB.1.8.1,鄰近國家/地區如中國、香港、日本、韓國仍以NB.1.8.1占比為高。疾管署指出,今年度公費流感及新冠疫苗已於11月1日起開放第二階段50至64歲無高風險慢性病成人接種,因應今年度接種情形踴躍,提醒符合第一階段公費資格而尚未接種的65歲以上長者等11類對象,儘速前往合約院所完成接種,以儘早獲得免疫保護力,降低感染後發生重症及死亡風險。另自今年11月12日起,再新增提供Novavax JN.1疫苗,屆時國內可供應莫德納 LP.8.1及Novavax JN.1兩種不同製程的公費新冠疫苗,均安全有效,滿12歲以上且尚未接種的公費對象可擇一廠牌接種,而滿6個月以上至11歲的公費對象依疫苗核准適應症,則可接種莫德納 LP.8.1疫苗,請符合公費資格之民眾儘速完成接種,以及早強化保護力。疾管署統計,截至今年11月3日,公費流感疫苗接種數約477.8萬人次,國內新冠疫苗接種累計約106.1萬人次,均約為去年同期的1.2倍。因疫苗接種約需2週的時間才能獲得足夠保護力,請民眾儘早前往合約院所接種,及早預防及減少感染及相關併發症發生風險。今年約有4,400餘家接種合約院所,另全聯、大全聯及家樂福亦於指定門市及時段設置疫苗接種站。

光澤醫美集團響應乳癌防治行動 以專業醫療傳遞粉紅力量陪伴女性重建自信
由《Marie Claire 美麗佳人》發起的「裙襬澎澎RUN」邁入第十一年,持續以實際行動推廣乳癌防治,同步舉辦「粉紅絲帶乳癌防治講座」,讓更多民眾認識正確防治觀念。光澤醫美集團秉持「美於形、安於心、專於質」的品牌理念,長期關注女性健康與公益議題。本次由光澤診所整形外科陳威臣醫師代表出席講座,分享乳房重建與術後照護的臨床經驗,期望透過專業醫療與溫暖陪伴,幫助更多女性重拾健康與自信。光澤醫美集團響應乳癌防治行動,以專業醫療傳遞粉紅力量陪伴女性重建自信。(圖片提供/光澤診所)乳癌多年來高居台灣女性癌症首位,每年確診人數持續攀升,但只要及早發現並積極治療,五年存活率即可超過九成。陳威臣醫師表示:「乳房重建不只是外觀的修復,更是一段陪伴女性走過創傷、重新擁抱生命的旅程。醫師不僅是治療者,更是陪伴者,透過專業與溫暖支持,幫助患者找到適合自己的重建時機與方式。」在講座現場,台灣癌症臨床研究發展基金會謝麗鳳護理長率先以「看一看、摸一摸、擠一擠」的口訣示範正確乳房自我檢查方法,提醒女性應養成每月自主檢測的習慣。隨後,陳威臣醫師深入分享假體重建、自體組織重建與重修手術的臨床經驗,指出乳房重建並非單一答案,而應依每位病友的身體條件與治療時程量身規劃。根據美國整形外科醫學會統計,接受乳房重建的患者,其憂鬱比例可降低 40% 至 50%,顯示重建對身心健康的正向影響。光澤醫美集團響應乳癌防治行動,以專業醫療傳遞粉紅力量陪伴女性重建自信。(圖片提供/光澤診所)光澤醫美集團將持續以專業醫療為核心,結合公益與關懷行動,過程中能重拾自信與面對生活的勇氣。美麗不僅來自外在的修復,更源自面對生命時的勇氣與愛。療程效果因人而異,並非保證每個人都有相同的效果;有關適應症、禁忌症等副作用等問題,療程前務必親自諮詢醫師,由醫師為專業說明和診斷https://www.dr-shine.com.tw/doctors/wei-chen-chen

熬夜壓力大小心「耳中風」 醫:急性突發性耳聾是警訊
中國醫藥大學新竹附設醫院胸腔暨重症科醫師鄭博斌提醒,一旦察覺到有急性突發性耳聾症狀,應快就醫,以免延誤治療。(圖/王惠慧攝)中國醫藥大學新竹附設醫院的胸腔暨重症科醫療團隊,運用高壓氧儀器治療病患急性突發性耳聾。(中醫大新竹附醫提供/王惠慧新竹傳真)新竹1名大學女畢業生,疑因找工作壓力大,加上長期熬夜看手機,某天早上突然單側耳朵聽不到、耳鳴、耳悶伴隨暈眩,就診後發現是「耳中風」。在做了耳內注射類固醇及口服類固醇治療後,轉介到胸腔暨重症科,安排高壓氧治療,經8次治療,目前狀況改善且重拾聽力。女畢業生經耳鼻喉科醫師診斷為急性突發性耳聾,俗稱「耳中風」。在做了耳內注射類固醇及口服類固醇治療後,轉介到中國醫藥大學新竹附設醫院胸腔暨重症科醫師鄭博斌門診。鄭博斌指出,急性突發性耳聾一般定義為3天內、至少連續3個相鄰測試音頻、各有超過30分貝的感音神經性聽閾值受損。造成急性突發性耳聾的原因可能與病毒感染、微血管阻塞、自體免疫疾病、神經腫瘤、藥物、甚至與長期熬夜及壓力大相關。因為有超過8至9成病人找不出確切病因,耳中風的正式名稱為「不明原因之突發性感音神經性聽損」。鄭博斌說明,耳中風(突發性耳聾)的原因尚不完全明確,但可能與病毒感染、血管阻塞、自體免疫疾病、生活壓力、熬夜作息不正常以及三高(高血壓、高血脂、高血糖)等因素有關,主要原因是供應內耳的血液循環受到阻礙或神經受損,導致突發性的聽力喪失。預防耳中風,主要在於降低風險因子,重點包括避免長時間暴露在高噪音環境,像是戴耳機時音量不宜過大;保持良好生活習慣,如充足睡眠、均衡飲食、規律運動和壓力管理,避免熬夜;三高和吸菸等高風險族群,要特別注意心血管健康並定期檢查鄭博斌指出,高壓氧治療急性突發性耳聾的臨床原理是藉由在一段特定時間之內,呼吸高於1.4個大氣壓力(1.4 ATA)的100%純氧,進而增加全身組織含氧量來改善內耳缺氧狀況。此外,高壓氧治療也可以降低血液黏稠度,增進血液在微血管的灌流以及增進組織修復能力。他提醒,美國海底暨高壓氧醫學會所訂定的高壓氧治療適應症總共有14項,急性突發性耳聾也是其中之一。所以,一旦察覺到有急性突發性耳聾症狀,應快就醫,以免延誤治療。

減重手術涉過度醫療 名醫宋天洲遭罰停業4月
減重名醫宋天洲爆「過度醫療」風波,高雄市政府衛生局調查發現,他在高雄博田國際醫院與義大大昌醫院為多名不符合手術條件的患者進行縮胃手術,違反醫療規範,衛生局依法移送懲戒,醫師懲戒委員會已決議自10月27日起,處宋停業4個月,並須完成醫學倫理與醫事法規各10小時進修課程。有家屬投訴,31歲女子體重54公斤、BMI24,仍接受宋天洲縮胃手術,術後出現嚴重併發症,包括食不下嚥、營養不良及體重驟降,7月中昏迷送醫,診斷為維他命B缺乏引發韋尼克氏腦病變,經住院一個多月治療,出院時體重剩37公斤,需輪椅代步,記憶力與情緒受損。家屬指控,患者術後回診未獲積極治療,醫師堅稱手術成功並不承認疏失,雙方調解破局;且手術費用高達24萬元,超過衛生局核定上限12萬元,呼籲主管機關徹查。衛生局表示,7月底接獲投訴後調查254份病歷,發現宋天洲多例手術不符減重手術適應症,且對未成年病患未完整評估即手術,屬過度醫療與違反醫學倫理,除停業外,因未報備執業及不實醫療廣告,被裁罰各15萬元。此外,衛生局也查出博田醫院管制藥品登載不實及未依規定保存簿冊,裁罰共12萬元;關於手術費用疑似超額收取,高市府將持續調查釐清,依法辦理。衛生局強調,此案涉及病人安全與兒少權益,已通報社會安全網並移送地檢署偵辦,未來將追蹤懲戒執行,並加強醫院與醫師監督,防止類似事件再發生。博田醫院表示,宋天洲為兼任合作醫師,對事件深感遺憾,將配合調查並強化醫師審查與管理,確保病人安全。

嬰幼兒染呼吸道融合病毒「重症機率高」 醫:每年約千名嬰幼兒感染住院
一名二個月大的吳小弟(33週早產兒),因出生週數不符合當時健保適應症,而未曾施打呼吸道融合病毒(RSV)單株抗體,入院前2天出現咳嗽有痰、流鼻水,並在入院當天發燒。奇美醫院兒科部主治醫師黃筱倫表示,吳小弟胸部X光顯示雙側上肺瀰漫狀浸潤,核酸檢驗顯示為呼吸道融合病毒(RSV)感染。吳小弟的3歲姐姐先前也有發燒、咳嗽症狀,推測為主要傳染源。早產兒RSV感染併發細菌感染 經治療後順利出院原本吳小弟在未接受抗生素治療下已退燒,但第3天再度發燒並出現呼吸衰竭與低血氧,情況危急,醫療團隊緊急將吳小弟送入加護病房並插管治療。進一步檢查發現,胸部X光顯示右上肺葉肺炎,從痰液樣本中培養出肺炎鏈球菌,為呼吸道融合病毒(RSV)感染併發細菌感染。經給予適當抗生素治療後,吳小弟在插管後第8天順利拔管,並於入院第17天完成抗生素療程後康復出院。四個月大嬰兒呼吸道融合病毒 經高流量氧氣鼻導管治療另一名四個月的鄭小妹(36週早產兒),入院前4天曾有發燒,之後陸續出現咳嗽、流鼻水等呼吸道症狀。由於鄭小妹的兩歲姐姐有類似症狀,加上白天在托嬰中心,很可能因此接觸到病原。入院當天出現呼吸喘伴隨喘鳴聲,由家人帶至奇美醫院急診就醫,採抗原快篩診斷出為呼吸道融合病毒(RSV)感染,隨即收治病房。入院後即開始給予氧氣帳與症狀治療,呼吸狀況逐漸改善,但於住院第5天出現呼吸喘且呈現胸凹狀,甚至血氧不穩等情況,改以高流量氧氣鼻導管治療。經過3天治療後,症狀逐漸緩解並順利移除鼻導管,入院後第8天康復出院。衛福部擴大RSV短效型單株抗體給付 可省下最高6萬醫療費用臺灣出生率逐年下降,但根據國民健康署2023年統計,臺灣早產兒(未滿37週)發生率高達10.88%,早產兒的比例10年來成長了1.8%,相當於每10個新生兒就有1個早產兒。衛生福利部中央健康保險署為守護早產兒健康,自2025年6月起,擴大呼吸道融合病毒(RSV)短效型單株抗體的健保給付範圍,將適用對象從原先的未滿33週早產兒,進一步涵蓋至未滿36週的早產兒,預計每年將有約8,600名早產兒受惠,為家長省下最高新臺幣6萬元的醫療費用。嬰幼兒住院「大魔王」 呼吸道融合病毒四大威脅 黃筱倫醫師指出,呼吸道融合病毒(respiratory syncytial virus;RSV)為幼兒細支氣管炎與肺炎住院最常見的原因之一。根據衛生福利部疾病管制署及相關醫學會資料,臺灣每年約有1,000名嬰幼兒因RSV感染住院,其中高達90%的個案發生在兩歲以下,而近幾個月RSV感染個案也有逐漸增加的趨向。對於早產兒、慢性肺病、先天性心臟病等高風險嬰幼兒,RSV感染不僅可能引發呼吸衰竭,還可能具有閘門效應,高達三成RSV感染嬰幼兒,可能併發肺炎鏈球菌與金黃色葡萄球菌等其他細菌感染,導致疾病嚴重度增加,並延長住院天數。黃筱倫醫師強調,RSV感染後具有「高感染」、「高重症」、「高插管」及「高誘發氣喘」四大威脅,包括:兩歲以下近九成兒童會感染、早產兒若出生3個月內感染,重症率與插管率分別高達7成與5成;此外,1歲內感染的兒童,5年內誘發氣喘的風險更是足月兒的3倍。【延伸閱讀】早產兒染RSV易重症、插管!健保擴增單株抗體給付 「未滿36週」皆受惠RSV疫苗與單株抗體怎麼選? 新手爸媽、長輩族群必看防護指南https://www.healthnews.com.tw/readnews.php?id=66464

47藥品擬退場!藥品供應拉警報 食藥署將修法強化缺藥通報
多款原廠藥陸續宣布退出台灣市場!基層藥師指出,今年至少7種原廠藥將退場,受影響藥品集中三高用藥,其中幾款市占率高,恐影響民眾用藥權益。食藥署回應,今年截至9月底,有47項藥品將退出台灣,但經評估,46項有可替代藥、1項可供應至明年底;食藥署已送出藥事法修正案,未來所有藥品退場都必須提前半年通報,以利政府因應。中華民國基層藥師協會理事長沈采穎指出,過去10年僅13款原廠藥退出,但今年已至少7種將退場,包括高血脂用藥美百樂(Mevalotin)、高血壓用藥安普諾維(Aprovel)、高血壓或心肌梗塞後心衰竭用藥心達舒錠(Tritace)、氣舒痰液、百憂解錠等。沈采穎表示,退出的藥品主要是三高用藥,有幾款市占率至少3到5成。國內慢性病患者多且年紀大,長久以來有習慣的藥物,若常用藥退場,造成慢性病患被迫頻繁換藥,或是患者搞混藥品名字和包裝等,可能影響民眾用藥權益。台大醫院北護分院家庭醫學科主治醫師黎家銘表示,美百樂、心達舒錠等三高用藥,上市時間長、臨床上用量也大,若在藥價上與健保署談不攏而退出市場,確實很可惜。雖然有同成份藥、學名藥可替代,但有些民眾有習慣使用的藥物,就必須改變用藥習慣,換藥後也須加強追蹤、確認血壓血脂變化。沈采穎說,今年退出藥品相比歷年大幅增加,是一種警訊,呼籲衛福部要積極因應,建立預警與應變機制,至少要求藥廠提前半年通報,食藥署要盤點國內缺藥狀況,評估藥品使用量、原料來源、是否有替代藥,或提前委託其他藥廠擴產填補缺口。食藥署長姜至剛表示,今年7至9月統計,有35種藥品將停止供應,經評估,其中22項有同成份、同劑型、同劑量「三同」學名藥可替代,12項雖無三同藥,但有同成分不同劑型、同藥理機轉或同適應症藥品可銜接使用,另1項為針劑Cyclosporine,原廠承諾可供應至明年底,國內也有藥廠評估專案製造。食藥署表示,今年整年共公告47項即將停止供應藥品,25項國內有三同藥品、21項有其他同成分不同劑型、或相同藥理機轉之藥品可替代,僅Cyclosporine公開徵求。姜至剛透露,過去僅「必要藥品」需提前半年通報退出市場,衛福部近期已送出藥事法修正草案,未來將擴大範圍,只要有藥廠將退出台灣或停產藥品,都必須提前半年通報,讓主管機關及早啟動因應機制。

藥華藥9月營收再創新高 累計前三季衝破百億
藥華藥(6446)最新公告9月營收13.2億元,月增3.44%,年增41.34%。累計前三季營收107.5億元,年增61.14%,不僅首度突破百億,更已超越去年全年,刷新營運里程碑。公司表示,美國與日本子公司銷售團隊已完成擴編與培訓,預期第四季起逐步展現效益,更為明年營收注入新動能。9月營收主要來自罕見血癌新藥Ropeginterferon alfa-2b(簡稱Ropeg,即P1101),其中美國市場出貨針數再創新高,顯示對Ropeg需求增長。Ropeg目前已獲全球近50個國家核准用於真性紅血球增多症(PV)患者並上市銷售,今年底前亦可望再取得墨西哥藥證。新適應症方面,原發性血小板過多症(ET)的藥證申請正加速推進。今年已完成中國、台灣、及日本的送件。美國FDA同意藥華藥直接送件,公司將於第四季正式向美國申請,並爭取優先審查資格,如順利獲准,有望最快於明年上半年取得美國藥證;如以標準審查資格進行,美國藥證則落在明年下半年,公司正面看待ET開啟營運的第二成長引擎。Ropeg用於ET的第三期臨床試驗「SURPASS ET」數據即將刊登於國際知名血液學專刊《The Lancet Haematology》,由血液學權威 Dr. Ruben A. Mesa 擔任通訊作者。該研究持續獲國際高度重視與肯定,凸顯Ropeg在ET治療的臨床價值,並將成為後續藥證審查及臨床應用的重要依據。此成果繼今年於美國臨床腫瘤學會(ASCO)及歐洲血液學協會(EHA)發表後,亦將積極爭取在美國血液學年會(ASH)中報告,持續提升Ropeg在三大國際血液學術會議的能見度與影響力。藥華藥亦積極拓展多適應症布局,持續打造長期成長曲線。在骨髓增生性腫瘤(MPN)治療領域中,公司已啟動針對Ropeg用於治療早前期原發性骨髓纖維化(PMF)患者的全球第三期臨床試驗 HOPE-PMF,計畫於台灣、美國、日本、中國等多國同步進行,目標招募150名受試者。公司繼8月8日在日本完成首位受試者給藥後,10月1日在臺大醫院完成臺灣第一位受試者給藥,目前已有多位患者參與試驗,臨床進度穩步推進。
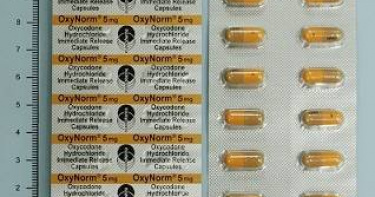
1款進口止痛藥將退場! 食藥署:國產藥年底上市
鴉片類止痛藥「奧諾美」過去仰賴進口,主要用於中重度癌症患者控制疼痛,需求量浩大。衛福部食藥署近日公告,待原進口藥品售罄後,獲食藥署管制藥品製藥工廠藥品許可證之國產「鹽酸羥可酮速效膠囊5毫克」,將於年底接棒上市,其與「奧諾美」的主成分、劑量與劑型相同,品質也符合國際標準。食藥署1日公告,食藥署管制藥品製藥工廠所輸入銷售的「奧諾美5毫克速效膠囊」(衛部藥輸字第026421號),變更為該廠所生產之「“管制藥品廠”鹽酸羥可酮速效膠囊5毫克」(衛部藥製字第061952號)。公告中說明,健保代碼為AC61952100,健保給付價格及廠所銷售價格均為每粒新台幣13元整,將自原輸入品售罄後開始供應。食藥署8日證實「奧諾美」進口藥將退場,指出原輸入銷售的「奧諾美5毫克速效膠囊」售罄後,開始供應販售國產自製「鹽酸羥可酮速效膠囊5毫克」管制藥品,主要是因應國藥國造政策,以強化藥品供應韌性,目前該藥品供應無虞。食藥署表示,「奧諾美」屬於二級管制藥,適應症包括需長期疼痛控制的中重度癌症病患,以及慢性中重度非癌症疼痛病患,且必須是已接受其他鴉片類藥物治療,仍無法止痛者。根據健保資料顯示,「奧諾美」台灣年用量約為358萬顆,可見需求量龐大。食藥署指出,國產自製「鹽酸羥可酮速效膠囊5毫克」預計2025年第4季供應販售,除生產品質符合PIC/S GMP國際標準外,也具備與原廠相同的主成分、劑量與劑型,並通過生體相等性(BE)試驗,證明療效一致,目前藥品供應無虞。

藥華藥前8月營收逾94億 年增64%「逼近去年一整年水準」
台股5日創新高收在24,494.58點,漲314.73點,漲幅達1.30%;藥華藥(6446)今(5)日公告8月營收12.7億元,年增41.35%。8月營收主要來自罕見血癌新藥Ropeginterferon alfa-2b(簡稱Ropeg,即P1101)。其中,美國市場出貨針數再創新高,顯示市場對Ropeg的需求持續增長;今年前8月累計營收已達94.4億元,年增64.36%,逼近去年全年水準。藥華藥今以525元開盤,收在510元,跌9.00元,跌幅為1.73%,連三漲後收跌。Ropeg目前已獲全球近50個國家核准用於真性紅血球增多症(Polycythemia Vera , PV)患者並上市銷售。今年第二季,公司取得阿根廷藥證,並已送件申請越南、加拿大藥證,年底前也有望再取得墨西哥藥證,加速擴大全球布局。在亞洲市場,Ropeg已於9月正式納入韓國健保給付。在新適應症方面,原發性血小板過多症(ET)的藥證申請推展順利。中國NMPA正式受理ET藥證申請後,審查程序順利啟動,中國子公司團隊已著手準備主管機關要求的資料(Information Request)。藥華藥計畫在9月向台灣及日本遞交ET藥證申請,同月亦將與美國FDA召開Pre-sBLA會議確認送件內容,預計於年底前完成送件。公司目標於2026年陸續取得全球ET藥證,並已展開商業化佈局,屆時將成為推動營運的第二成長引擎。此外,在骨髓增生性腫瘤(MPN)治療領域中,藥華藥正式啟動針對Ropeg用於治療早前期原發性骨髓纖維化(PMF)患者的全球第三期臨床試驗 HOPE-PMF,試驗規劃於台灣、美國、日本、中國等多國同步進行,目標招募150名受試者,預計2026年第一季完成收案。

電擊復活!BBU族群題材點火 台達電攜「4檔」爆量攻漲停
台股5日創新高收在24,494.58點,漲314.73點,漲幅達1.30%;藥華藥(6446)今(5)日公告8月營收12.7億元,年增41.35%。8月營收主要來自罕見血癌新藥Ropeginterferon alfa-2b(簡稱Ropeg,即P1101)。其中,美國市場出貨針數再創新高,顯示市場對Ropeg的需求持續增長;今年前8月累計營收已達94.4億元,年增64.36%,逼近去年全年水準。藥華藥今以525元開盤,收在510元,跌9.00元,跌幅為1.73%,連三漲後收跌。Ropeg目前已獲全球近50個國家核准用於真性紅血球增多症(Polycythemia Vera , PV)患者並上市銷售。今年第二季,公司取得阿根廷藥證,並已送件申請越南、加拿大藥證,年底前也有望再取得墨西哥藥證,加速擴大全球布局。在亞洲市場,Ropeg已於9月正式納入韓國健保給付。在新適應症方面,原發性血小板過多症(ET)的藥證申請推展順利。中國NMPA正式受理ET藥證申請後,審查程序順利啟動,中國子公司團隊已著手準備主管機關要求的資料(Information Request)。藥華藥計畫在9月向台灣及日本遞交ET藥證申請,同月亦將與美國FDA召開Pre-sBLA會議確認送件內容,預計於年底前完成送件。公司目標於2026年陸續取得全球ET藥證,並已展開商業化佈局,屆時將成為推動營運的第二成長引擎。此外,在骨髓增生性腫瘤(MPN)治療領域中,藥華藥正式啟動針對Ropeg用於治療早前期原發性骨髓纖維化(PMF)患者的全球第三期臨床試驗 HOPE-PMF,試驗規劃於台灣、美國、日本、中國等多國同步進行,目標招募150名受試者,預計2026年第一季完成收案。
網紅名醫王銘嶼減重手術釀2死 衛生局開鍘廢照、醫院挨罰
在網路上以減重手術頗有名氣的高雄市安泰醫院網紅醫師王銘嶼,在6到7月短短10天內,就有2名患者在手術後死亡,受害家屬向立委陳情後引發關注,高雄市衛生局經調查後,已處王銘嶼停業2月並移送地檢署偵辦,後續調查發現王銘嶼與院方設及多項違規,今(3)日宣布廢止王銘嶼醫師執照並處安泰醫院外科門診及住院業務停業3個月。據了解,死者林姓女子7月份從北部地區南下到高雄,因長期受胃酸逆流、嘔吐狀況困擾,找網紅王銘嶼自費百萬施作「腸胃道重建手術」,不料術後24小時出現肺部併發症、肺栓塞等狀況、2天後身亡;另有許姓患者在6月30日找上王銘嶼花費24萬進行縮胃擴腸手術,術後多日也因多項併發症死亡。對此高雄市衛生局,已在8月初針對王醫疑涉過度醫療、收費過高等情節,確認安泰醫院向66名病患收取超出規定的「腹腔鏡胃縮小併小腸繞道手術」費用,裁罰25萬元,並責令院方於明年9月底前退還所有超收費用。此外,王銘嶼歷記載不全、護理紀錄簽章不完整、刊登醫療廣告未說明風險與適應症,衛生局也分別依醫師法與醫療法處以罰鍰共13萬元,另對管制藥品登載不符處以相關裁處,並查獲手術室內疑似來源不明醫療器材,及以個人公司名義向病患收取費用,已於8月7日起勒令其停業2月,待調查確認後移送司法偵辦。網紅醫師王銘嶼先前遭爆在10天內有2名患者在術後死亡,經高雄市衛生局調查後確認涉及多項違規,今(3)日宣布廢止王銘嶼醫師執照,並處所服務的安泰醫院外科門診及住院業務停業3個月。(圖/趙世勳攝)衛生局今日表示,8月22日舉行醫師懲戒會,王銘嶼因執行手術未符國際標準,已涉及「過度醫療」行為,經決議依《醫療法》第25-1條廢止其執業執照。針對安泰醫院放任王銘嶼執行爭議手術,衛生局認為醫院明顯有業務管理疏失不當且致患者傷亡、使用非合法醫療器材執行手術及管制藥品流向不明等,已違反多項《醫療法》規定,依法處罰鍰10萬元整,並命該院自8月28日起,該院外科門診、住院業務停業處分3個月,自8月27日起生效。衛生局指出,亦查獲該院縮胃擴腸手術收費超出「高雄市醫療機構暨醫事機構收取醫療費用標準」,超收達67人,依《醫療法》第22條第2項規定每案裁處新臺幣5萬元罰鍰,共計罰鍰新臺幣335萬元,限今年9月30日前將超收費用返還,該院負責醫師違反同法第68條第1項規定,處罰鍰新臺幣1萬元整;另外涉及管制藥品未詳實登載簿冊,依《管制藥品管理條例》規定處罰鍰新臺幣6萬元整,同時該院涉管制藥品流用、未經核准擅自供應、寄藏醫療器材,依法移送檢調偵辦。衛生局說安泰醫院停業生效後,要求院方妥適安排既有病患,若有需要衛生局協助轉介可主動提出;安泰醫院則在臉書上聲明,因醫療業務調整,至今年11月底前暫停住院及外科門診服務,其他科別門診及健康檢查等業務照常。

減重題材發威外資連日狂敲 「這檔」19日不畏大盤逆勢飆漲停
市場持續聚焦醫美與減重市場的新藥開發,康霈*(6919)近5日股價上漲21.76%,今(19)日不畏大盤逆勢飆漲停,市場持續聚焦其CBL-514脂肪細胞標靶新藥,法人預期康霈*將陸續完成臨床試驗並對外授權,授權金有望挹注營收與獲利。台北股市今日開高走低,截至收稿下跌0.4%,暫報24386.02點。康霈*不畏大盤逆勢飆漲停,開高勁揚9.71%,報市價175元,外資連續多日大舉買超,資金流向生技醫療族群,帶動康霈*市值再創新高。近年來非手術減脂產品快速崛起,包括冷凍減脂、超音波減脂、減脂注射劑等。而CBL-514打破過去醫美藥物或設備的仿單適應症僅限於「外觀改善」的慣例,更是全球第一個針對大範圍的非手術減脂的創新療法。股價近日飆升主因在於市場持續聚焦其CBL-514脂肪細胞標靶新藥,短線題材熱度高,投資人關注新藥進度與授權時程。法人預期2025至2027年將陸續完成臨床驗證並對外授權,授權金有望挹注營收與獲利。

工作到一半突然耳中風! 醫:靠高壓氧輔助恢復聽力
55歲從事業務的陳小姐某日一如往常上班工作,用手機聯絡客戶時,右耳突然聽不見電話那頭的聲音,換到左耳卻又可以正常地聽到。緊張萬分的陳小姐連忙趕到仁愛長庚合作聯盟醫院(大里仁愛醫院)耳鼻喉科求診,在做完聽力檢查後,發現竟是突發性耳聾,於是趕緊住院治療,並照會高壓氧中心李祥安主任評估及安排高壓氧治療。經過治療四週後,陳小姐終於恢復在生活中較常使用的低頻區聽力,回歸正常生活。耳中風與腦中風不同 多數病因不明且易被疏忽延誤就醫李祥安主任說明,突發性耳聾是一種急性聽力受損的疾病,俗稱耳中風,但跟一般常見的腦中風因腦血管血栓阻塞或腦動脈瘤破裂出血的情況不同。突發性耳聾目前可能的病因包含:內耳毛細胞組織缺血或缺氧、內耳內淋巴水腫、病毒感染導致之神經炎、自體免疫疾病或聽神經瘤等。大約只有兩成的人可以找到確切病因,其餘大部分病患的致病原因不明,這也使診斷及治療上帶來不少困擾。李祥安主任指出,突發性耳聾的常見症狀為突然發現其中一側之聽力減弱、耳鳴、耳悶感,甚至合併暈眩等,其診斷定義為:最近三日內在純音聽力圖上連續三個頻率感覺神經性聽力與對側正常耳比較,有聽力下降超過30分貝。需要特別注意的是,有時患側聽力只有部分頻率聽力受損,還是可以聽到部分的聲音,故會被疏忽而延誤了就醫及治療的時間點。把握發病後一到兩週內黃金治療期 高壓氧輔助恢復聽力李祥安主任表示,突發性耳聾的黃金治療期通常是發病後的一到兩週內,治療是以抗發炎藥物、改善血液循環及組織灌流為原則。目前療效最被確認的是類固醇藥物(包含口服、靜脈注射及內耳注射),其它治療包括:靜脈輸液、血漿擴張劑、末梢血管舒張劑等。近年來已有許多文獻支持高壓氧用於突發性耳聾之輔助治療,高壓氧治療是藉由呼吸高壓純氧來增加血漿中氧氣的分壓及溶氧量並增加內耳淋巴液之氧氣分壓。另外,高壓氧氣治療也可降低血比容、降低血液黏滯度及增加紅血球彈性,進而改善微循環,對改善組織血液灌流與缺氧亦有相當助益。在美國及台灣的高壓氧醫學會皆把突發性耳聾列為高壓氧治療適應症之一。李祥安主任建議,年輕(小於50歲)且有中重度聽力損失(平均聽力大於60分貝)的突發性耳聾病人,在傳統治療下再輔以高壓氧治療,增加恢復聽力的可能性。【延伸閱讀】3分鐘搞定聽力篩檢!醫療科技展免費體驗 守護聽力健康用聲音點燃希望「聽力之星公益計畫」溫暖啟航https://www.healthnews.com.tw/readnews.php?id=65543